/ химия белки
белки
БЕЛКИ — это азотсодержащие высокомолекулярные органические вещества со сложным
составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют
в животных организмах, которые состоят из тех или иных форм белков (мышцы,
покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части a-аминокислоты) из углекислого
газа СО2 и воды Н2О за счет фотосинтеза, усваивая
остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из
растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их
базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты)
могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с
количеством, свойствами и способах соединения входящих в их молекулу
аминокислот. Белки выполняют функцию биокатализаторов — ферментов,
регулирующих скорость и направление химических реакций в организме. В
комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи
наследственных признаков, являются структурной основой мышц и осуществляют
мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)—NH, названные
пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или
тысячи аминокислотных звеньев.
Структура белков:
|
Особый характер белка каждого вида связан не только с длиной, составом и
строением входящих в его молекулу полипептидных цепей, но и с тем, как эти
цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
1. Первичная структура белка — специфическая последовательность аминокислот
в полипептидной цепи.
|
|
|
|
2.
|
Вторичная структура белка — способ скручивания полипептидной цепи в
пространстве (за счет водородной связи между водородом амидной группы —NH— и
карбонильной группы — СО—, которые разделены четырьмя аминокислотными
фрагментами).
3.
|
Третичная структура белка — реальная трехмерная конфигурация закрученной
спирали полипептидной цепи в пространстве (спираль, скрученная в спираль).
Третичная структура белка обуславливает специфическую биологическую
активность белковой молекулы. Третичная структура белка поддерживается за
счет взаимодействия различных функциональных групп полипептидной цепи:
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик – между карбоксильной группой (-СО-) и
гидроксильной (-ОН),
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (NH2).
|
|
4. Четвертичная структура белка — тип взаимодействия между несколькими
полипептидными цепями.
|
Например, гемоглобин представляет из себя комплекс из четырех макромолекул
белка.
Физические свойства
Белки имеют большую молекулярную массу ( 104—107), многие
белки растворимы в воде, но образуют, как правило, коллоидные растворы, из
которых выпадают при увеличении концентрации неорганических солей, добавлении
солей тяжелых металлов, органических растворителей или при нагревании
(денатурация).
Химические свойства
1. Денатурация — разрушение вторичной и третичной структуры белка.
2. Качественные реакции на белок:
n биуретовая реакция: фиолетовое окрашивание при обработке солями меди в
щелочной среде (дают все белки),
n ксантопротеиновая реакция: желтое окрашивание при действии
концентрированной азотной кислоты, переходящее в оранжевое под действием
аммиака (дают не все белки),
n выпадение черного осадка (содержащего серу) при добавлении ацетата свинца
(II), гидроксида натрия и нагревании.
3. Гидролиз белков — при нагревании в щелочном или кислом растворе с
образованием аминокислот.
Синтез белков
Белок — сложная молекула, и синтез его представляется трудной задачей. В
настоящее время разработано много методов прекращения [ГМВ1]
a-аминокислот в пептиды и синтезированы простейшие природные белки — инсулин,
рибонуклеаза и др.
Большая заслуга в создании микробиологической промышленности по производству
искусственных пищевых продуктов принадлежит советскому ученому
А.Н.Несмеянову.
Литература:
“ХИМИЯ” М.,”СЛОВО” 1995.
Г.Е.Рудзитис, Ф.Г.Фельдман
“Химия 11. Органическая химия”
М., “Просвещение”,1993.
А.И.Артеменко, И.В. Тикунова
“Химия 10-11. Органическая химия”
М., “Просвещение” 1993.
StudFiles.ru
СВОЙСТВА БЕЛКОВ
БЕЛКИ
Белки – это высокомолекулярные вещества, состоящие из аминокислот, соединенных пептидной связью. Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке.
Функции белков:
1. Каталитическая функция. Наиболее многочисленную группу белков составляют ферменты – белки с каталитической активностью, ускоряющие химические реакции. Примерами ферментов являются пепсин, алкогольдегидрогеназа, глутаминсинтетаза.
2. Структурообразующая функция. Структурные белки отвечают за поддер-жание формы и стабильности клеток и тканей, к ним относятся кератины, коллаген, фиброин.
3. Транспортная функция. Транспортные белки переносят молекулы или ионы из одного органа в другой или через мембраны внутри клетки, например, гемоглобин, сывороточный альбумин, ионные каналы.
4. Защитная функция. Белки системы гомеостаза защищают организм от возбудителей болезней, чужеродной информации, потери крови – иммуноглобулины, фибриноген, тромбин.
5. Регуляторная функция. Белки осуществляют функции сигнальных веществ – некоторых гормонов, гистогормонов и нейромедиаторов, являются рецепторами к сигнальным веществам любого строения, обеспечивают дальнейшую передачу сигнала в биохимических сигнальных цепях клетки. Примерами могут служить гормон роста соматотропин, гормон инсулин, Н- и М-холинорецепторы.
6. Двигательная функция. С помощью белков осуществляются процессы сокращения и другого биологического движения. Примерами могут служить тубулин, актин, миозин.
7. Запасная функция. В растениях содержатся запасные белки, являющиеся ценными пищевыми веществами, в организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Для белков характерным является наличие нескольких уровней структурной организации.
Первичной структурой белка называют последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь – это карбоксамидная связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
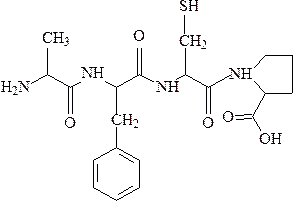 аланилфенилаланилцистеилпролин
аланилфенилаланилцистеилпролин
У пептидной связи есть несколько особенностей:
а) она резонансно стабилизирована и поэтому находится практически в одной плоскости – планарна; вращение вокруг связи С-N требует больших затрат энергии и затруднено;
б) у связи -CO-NH- особый характер, она меньше, чем обычная, но больше, чем двойная, то есть существует кето-енольная таутомерия:

в) заместители по отношению к пептидной связи находятся в транс-положении;
г) пептидный остов окружен разнообразными по своей природе боковыми цепями, взаимодействуя с окружающими молекулами растворителя, свободные карбоксильные и аминогруппы ионизируются, образуя катионные и анионные центры молекулы белка. В зависимости от их соотношения белковая молекула получает суммарный положительный или отрицательный заряд, а также характеризуется тем или иным значением рН среды при достижении изоэлектрической точки белка. Радикалы образуют солевые, эфирные, дисульфидные мостики внутри молекулы белка, а также определяют круг реакций, свойственных белкам.
В настоящее время условились считать белками полимеры, состоящие из 100 и более аминокислотных остатков, полипептидами – полимеры, состоящие из 50-100 аминокислотных остатков, низкомолекулярными пептидами – полимеры, состоящие из менее 50 аминокислотных остатков.
Некоторые низкомолекулярные пептиды играют самостоятельную биологическую роль. Примеры некоторых таких пептидов:
Глутатион – γ-глу-цис-гли – один из наиболее широко распространен-ных внутриклеточных пептидов, принимает участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны.
Карнозин – β-ала-гис – пептид, содержащийся в мышцах животных, устраняет продукты перекисного расщепления липидов, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышцах.
Вазопрессин – гормон задней доли гипофиза, участвующий в регуля-ции водного обмена организма:
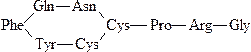
Фаллоидин – ядовитый полипептид мухомора, в ничтожных концентрациях вызывает гибель организма вследствие выхода ферментов и ионов калия из клеток:

Грамицидин – антибиотик, действующий на многие грамположительные бактерии, изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток:
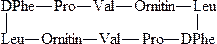
Мет-энкефалин – тир-гли-гли-фен-мет – пептид, синтезирующийся в нейронах и ослабляющий болевые ощущения.
Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова.
Пептидная цепь содержит множество СО- и NH-групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. Существуют два главных типа структур, которые позволяют это осуществить: α-спираль, в которую цепь свертывается как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны.
α-Спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, на каждый виток правозакрученной спирали приходится 3,6 аминокислотных остатка, радикалы которых направлены всегда наружу и немного назад, то есть в начало полипептидной цепи.
Основные характеристики α-спирали:
1) α-спираль стабилизируется водородными связями между атомом водорода при азоте пептидной группы и карбонильным кислородом остатка, отстоящего от данного вдоль цепи на четыре позиции;
2) в образовании водородной связи участвуют все пептидные группы, это обеспечивает максимальную стабильность α-спирали;
3) в образовании водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность α-спиральных областей и увеличивает их гидрофобность;
4) α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии;
5) в полипептидной цепи из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
Возможность образования α-спирали обусловлена первичной структурой белка. Некоторые аминокислоты препятствуют закручиванию пептидного остова. Например, расположенные рядом карбоксильные группы глутамата и аспартата взаимно отталкиваются друг от друга, что препятствует образованию водородных связей в α-спирали. По этой же причине затруднена спирализация цепи в местах близко расположенных друг к другу положительно заряженных остатков лизина и аргинина. Однако наибольшую роль в нарушении α-спирали играет пролин. Во-первых, в пролине атом азота входит в состав жесткого кольца, что препятствует вращению вокруг связи N-C, во-вторых, пролин не образует водородную связь из-за отсутствия водорода при атоме азота.
β-складчатость – это слоистая структура, образуемая водородными связями между линейно расположенными пептидными фрагментами. Обе цепи могут быть независимыми или принадлежать одной молекуле полипептида. Если цепи ориентированы в одном направлении, то такая β-структура называется параллельной. В случае противоположного направления цепей, то есть когда N-конец одной цепи совпадает с С-концом другой цепи, β-структура называется антипараллельной. Энергетически более предпочтительна антипараллельная β-складчатость с почти линейными водородными мостиками.
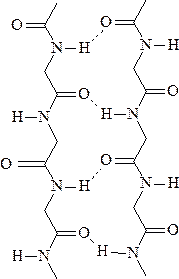
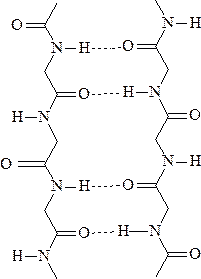
параллельная β-складчатость антипараллельная β-складчатость
В отличие от α-спирали, насыщенной водородными связями, каждый участок цепи β-складчатости открыт для образования дополнительных водородных связей. Боковые радикалы аминокислот ориентированы почти перпендикулярно плоскости листа попеременно вверх и вниз.
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка изгибаются на 180о и стабилизируются одним водородным мостиком между первым и четвертым остатками. Большие аминокислотные радикалы мешают образованию β-петли, поэтому в нее чаще всего входит самая маленькая аминокислота глицин.
Надвторичная структура белка – это некоторый специфический порядок чередования вторичных структур. Под доменом понимают обособленную часть молекулы белка, обладающую в определенной степени структурной и функциональной автономией. Сейчас домены считают фундаментальными элементами структуры белковых молекул и соотношение и характер компоновки α-спиралей и β-слоев дает для понимания эволюции белковых молекул и филогенетических связей больше, чем сопоставление первичных структур.
Главной задачей эволюции является конструирование все новых белков. Бесконечно мал шанс случайно синтезировать такую аминокислотную последовательность, которая бы удовлетворила условиям упаковки и обеспечила выполнение функциональных задач. Поэтому часто встречаются белки с различной функцией, но сходные по структуре настолько, что кажется, что они имели одного общего предка или произошли друг от друга. Похоже, что эволюция, столкнувшись с необходимостью решить определенную задачу, предпочитает не конструировать для этого белки сначала, а приспособить для этого уже хорошо отлаженные структуры, адаптируя их для новых целей.
Некоторые примеры часто повторяющихся надвторичных структур:
1) αα’ – белки, содержащие только α-спирали (миоглобин, гемоглобин);
2) ββ’ – белки, содержащие только β-структуры (иммуноглобулины, супероксиддисмутаза);
3) βαβ’ – структура β-бочонка, каждый β-слой расположен внутри бочонка и связан с α-спиралью, находящейся на поверхности молекулы (триозофосфоизомераза, лактатдегидрогеназа);
4) «цинковый палец» – фрагмент белка, состоящий из 20 аминокислотных остатков, атом цинка связан с двумя остатками цистеина и двумя гистидина, в результате чего образуется «палец» из примерно 12 амино-кислотных остатков, может связываться с регуляторными участками молекулы ДНК;
5) «лейциновая застежка-молния» – взаимодействующие белки имеют α-спиральный участок, содержащий по крайней мере 4 остатка лейцина, они расположены через 6 аминокислот один от другого, то есть находятся на поверхности каждого второго витка и могут образовывать гидрофобные связи с лейциновыми остатками другого белка. С помощью лейциновых застежек, например, молекулы сильноосновных белков гистонов могут объединяться в комплексы, преодолевая положительный заряд.
Третичная структура белка – это пространственное расположение молекулы белка, стабилизируемое связями между боковыми радикалами аминокислот.
Типы связей, стабилизирующих третичную структуру белка:
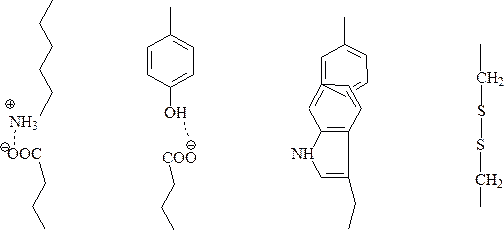
электростатическое водородные гидрофобные дисульфидные взаимодействие связи взаимодействия связи
В зависимости от складывания третичной структуры белки можно классифицировать на два основных типа – фибриллярные и глобулярные.
Фибриллярные белки – нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси. В основном это структурные и сократительные белки. Несколько примеров самых распространенных фибриллярных белков:
1. α-Кератины. Синтезируются клетками эпидермиса. На их долю приходится почти весь сухой вес волос, шерсти, перьев, рогов, ногтей, когтей, игл, чешуи, копыт и черепашьего панциря, а также значительная часть веса наружного слоя кожи. Это целое семейство белков, они сходны по аминокислотному составу, содержат много остатков цистеина и имеют одинаковое пространственное расположение полипептидных цепей.
В клетках волос полипептидные цепи кератина сначала организуются в волокна, из которых затем формируются структуры наподобие каната или скрученного кабеля, заполняющего в конце концов все пространство клетки. Клетки волос становятся при этом уплощенными и, наконец, отмирают, а клеточные стенки образуют вокруг каждого волоса трубчатый чехол, называемый кутикулой. В α-кератине полипептидные цепи имеют форму α-спирали, скручены одна вокруг другой в трехжильный кабель с образованием поперечных дисульфидных связей.
N-концевые остатки расположены с одной стороны (параллельны). Кератины нерастворимы в воде из-за преобладания в их составе аминокислот с неполярными боковыми радикалами, которые обращены в сторону водной фазы. При химической завивке происходят следующие процессы: вначале путем восстановления тиолами разрушаются дисульфидные мостики, а затем при придании волосам необходимой формы их высушивают нагреванием, при этом за счет окисления кислородом воздуха образуются новые дисульфидные мостики, которые сохраняют форму прически.
2. β-Кератины. К ним относятся фиброин шелка и паутины. Представляют из себя антипараллельные β-складчатые слои с преобладанием глицина, аланина и серина в составе.
3. Коллаген. Самый распространенный белок у высших животных и главный фибриллярный белок соединительных тканей. Коллаген синтезируется в фибробластах и хондроцитах – специализированных клетках соединительной ткани, из которых затем выталкивается. Коллагеновые волокна находятся в коже, сухожилиях, хрящах и костях. Они не растяги-ваются, по прочности превосходят стальную проволоку, коллагеновые фибриллы характеризуются поперечной исчерченностью.
При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин в результате гидролиза некоторых ковалентных связей. Коллаген содержит 35% глицина, 11% аланина, 21% пролина и 4-гидроксипролина (аминокислоты, свойственной только для коллагена и эластина). Такой состав определяет относительно низкую питательную ценность желатина как пищевого белка. Фибриллы коллагена состоят из повторяющихся полипептидных субъединиц, называемых тропоколлагеном. Эти субъединицы уложены вдоль фибриллы в виде параллельных пучков по типу «голова к хвосту». Сдвинутость головок и придает характерную поперечную исчерченность. Пустоты в этой структуре при необходимости могут служить местом отложения кристаллов гидроксиапатита Са5(ОН)(РО4)3, играющего важную роль в минерализации костей.

Тропоколлагеновые субъединицы состоят из трех полипептидных цепей, плотно скрученных в виде трехжильного каната, отличающегося от α- и β-кератинов. В одних коллагенах все три цепи имеют одинаковую аминокислотную последовательность, тогда как в других идентичны только две цепи, а третья отличается от них. Полипептидная цепь тропоколлагена образует левую спираль, на один виток которой приходится только три аминокислотных остатка из-за изгибов цепи, обусловленной пролином и гидроксипролином. Три цепи связаны между собой кроме водородных связей связью ковалентного типа, образующейся между двумя остатками лизина, находящимися в соседних цепях:
По мере того как мы становимся старше, в тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена более жесткими и хрупкими, и это изменяет механические свойства хрящей и сухожилий, делает более ломкими кости и понижает прозрачность роговицы глаза.
4. Эластин. Содержится в желтой эластичной ткани связок и эластическом слое соединительной ткани в стенках крупных артерий. Основная субъединица фибрилл эластина – тропоэластин. Эластин богат глицином и аланином, содержит много лизина и мало пролина. Спиральные участки эластина растягиваются при натяжении, но возвращаются при снятии нагрузки к исходной длине. Остатки лизина четырех разных цепей образуют ковалентные связи между собой и позволяют эластину обратимо растягиваться во всех направлениях.
Глобулярные белки – белки, полипептидная цепь которых свернута в компактную глобулу, способны выполнять самые разнообразные функции.
Третичную структуру глобулярных белков удобнее всего рассмотреть на примере миоглобина. Миоглобин – это относительно небольшой кислород-связывающий белок, присутствующий в мышечных клетках. Он запасает связанный кислород и способствует его переносу в митохондрии. В молекуле миоглобина находится одна полипептидная цепь и одна гемогруппа (гем) – комплекс протопорфирина с железом.
Основные свойства миоглобина:
а) молекула миоглобина настолько компактна, что внутри нее может уместиться всего 4 молекулы воды;
б) все полярные аминокислотные остатки, за исключением двух, расположены на внешней поверхности молекулы, причем все они находятся в гидратированном состоянии;
в) большая часть гидрофобных аминокислотных остатков расположена внутри молекулы миоглобина и, таким образом, защищена от соприкосно-вения с водой;
г) каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи, в других местах изгиба расположены остатки серина, треонина и аспарагина, так как такие аминокислоты препятствуют образованию α-спирали, если находятся друг с другом;
д) плоская гемогруппа лежит в полости (кармане) вблизи поверхности молекулы, атом железа имеет две координационные связи, направленные перпендикулярно плоскости гемма, одна из них связана с остатком гистидина 93, а другая служит для связывания молекулы кислорода.
Начиная с третичной структуры белок становится способным выполнять свойственные ему биологические функции. В основе функционирования белков лежит то, что при укладке третичной структуры на поверхности белка образуются участки, которые могут присоединять к себе другие молекулы, называемые лигандами. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей. Для большей части белков третичная структура – максимальный уровень укладки.
Четвертичная структура белка – характерна для белков, состоящих из двух и более полипептидных цепей, связанных между собой исключительно нековалентными связями, в основном электростатическими и водородными. Чаще всего белки содержат две или четыре субъединицы, более четырех субъединиц обычно содержат регуляторные белки.
Белки, имеющие четвертичную структуру, часто называются олигомерными. Различают гомомерные и гетеромерные белки. К гомо-мерным относятся белки, у которых все субъединицы имеют одинаковое строение, например, фермент каталаза состоит их четырех абсолютно одинаковых субъединиц. Гетеромерные белки имеют разные субъединицы, например, фермент РНК-полимераза состоит из пяти разных по строению субъединиц, выполняющих разные функции.
Взаимодействие одной субъединицы со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других субъединиц к лигандам, это свойство лежит в основе способности олигомерных белков к аллостерической регуляции.
Четвертичную структуру белка можно рассмотреть на примере гемоглобина. Содержит четыре полипептидных цепи и четыре простетические группы гема, в которых атомы железа находятся в закисной форме Fe2+. Белковая часть молекулы – глобин – состоит из двух α-цепей и двух β-цепей, содержащих до 70% α-спиралей. Каждая из четырех цепей имеет характерную для нее третичную структуру, с каждой цепью связана одна гемогруппа. Гемы разных цепей сравнительно далеко расположены друг от друга и имеют разный угол наклона. Между двумя α-цепями и двумя β-цепями образуется мало прямых контактов, тогда как между α- и β-цепями возникают многочисленные контакты типа α1β1 и α2β2, образованные гидрофобными радикалами. Между α1β1 и α2β2 остается канал.
В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду, что позволяет ему при существующих в тканях низких парциальных давлениях кислорода отдавать им значительную часть связанного кислорода. Кислород легче связывается железом гемоглобина при более высоких значениях рН и низкой концентрации СО2, свойственные альвеолам легких; освобождению кислорода из гемоглобина благоприятствуют более низкие значения рН и высокие концентрации СО2, свойственные тканям.
Кроме кислорода гемоглобин переносит ионы водорода, которые связываются с остатками гистидина в цепях. Также гемоглобин переносит углекислый газ, который присоединяет к концевой аминогруппе каждой из четырех полипептидных цепей, в результате чего образуется карбаминогемоглобин:

В эритроцитах в достаточно больших концентрациях присутствует вещество 2,3-дифосфоглицерат (ДФГ), его содержание увеличивается при подъеме на большую высоту и при гипоксии, облегчая высвобождение кислорода из гемоглобина в тканях. ДФГ располагается в канале между α1β1 и α2β2, взаимодействуя с положительно зараженными группами β-цепей. При связывании гемоглобином кислорода ДФГ вытесняется из полости. В эритроцитах некоторых птиц содержится не ДФГ, а инозитолгекса-фосфат, который еще больше снижает сродство гемоглобина к кислороду.
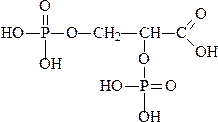 2,3-дифосфоглицерат (ДФГ)
2,3-дифосфоглицерат (ДФГ)
HbA – нормальный гемоглобин взрослого человека, HbF – фетальный гемоглобин, имеет большее сродство к О2, HbS – гемоглобин при серповидноклеточной анемии. Серповидноклеточная анемия – это серьезное наследственное заболевание, связанное с генетической аномалией гемоглобина. В крови больных людей наблюдается необычно большое количество тонких серповидных эритроцитов, которые, во-первых, легко разрываются, во-вторых, закупоривают кровеносные капилляры.
На молеку-лярном уровне гемоглобин S отличается от гемоглобина А по одному аминокислотному остатку в положении 6 β-цепей, где вместо остатка глутаминовой кислоты находится валин. Таким образом, гемоглобин S содержит на два отрицательных заряда меньше, появление валина приводит к возникновению «липкого» гидрофобного контакта на поверхности молекулы, в результате при дезоксигенации молекулы дезоксигемоглобина S слипаются и образуют нерастворимые аномально длинные нитевидные агрегаты, приводящие к деформации эритроцитов.
Нет никаких оснований думать, что существует независимый генетический контроль за формированием уровней структурной организации белка выше первичного, поскольку первичная структура определяет и вторичную, и третичную, и четвертичную (если она имеется). Нативной конформацией белка является термодинамически наиболее устойчивая в данных условиях структура.
ЛЕКЦИЯ 6
Различают физические, химические и биологические свойства белков.
Физическими свойствами белков являются наличие молекулярной массы, двойное лучепреломление (изменение оптической характеристики раствора белка, находящегося в движении, по сравнению с раствором, находящимся в покое), обусловленное несферической формой белков, подвижность в электрическом поле, обусловленная зарядом молекул белка. Кроме этого для белков характерны оптические свойства, заключающиеся в способности вращать плоскость поляризации света, рассеивать световые лучи ввиду значительных размеров белковых частиц и поглощать ультрафиолетовые лучи.
Одним из характерных физических свойств белков являются способность адсорбировать на поверхности, а иногда и захватывать внутрь молекулы, низкомолекулярные органические соединения и ионы.
Химические свойства белков отличаются исключительным разнообразием, так как для белков характерны все реакции аминокислотных радикалов и характерна реакция гидролиза пептидных связей.
Имея значительное число кислотных и основных групп, белки проявляют амфотерные свойства. В отличие от свободных аминокислот кислотно-основные свойства белков обусловлены не α-амино- и α-карбокси-группами, занятыми в образовании пептидных связей, а заряженными радикалами аминокислотных остатков. Основные свойства белков обусловлены остатками аргинина, лизина и гистидина. Кислые свойства обусловлены остатками аспарагиновой и глутаминовой кислоты.
Кривые титрования белков достаточно сложны для интерпретации, так как в любом белке имеется слишком большое число титруемых групп, между ионизированными группами белка имеются электростатические взаимодействия, на рК каждой титруемой группы оказывают влияние рядом расположенные гидрофобные остатки и водородные связи. Наибольшее практическое применение имеет изоэлектрическая точка белка – значение рН, при котором суммарный заряд белка равен нулю. В изоэлектрической точке белок максимально инертен, не перемещается в электрическом поле и имеет наиболее тонкую гидратную оболочку.
Белки проявляют буферные свойства, но их буферная емкость незначительна. Исключение составляют белки, содержащие большое число остатков гистидина. Например, содержащийся в эритроцитах гемоглобин за счет очень высокого содержания остатков гистидина имеет значительную буферную емкость при рН около 7, что весьма важно для той роль, которую играют эритроциты в переносе кровью кислорода и углекислого газа.
Для белков характерна растворимость в воде, причем с физической точки зрения они образуют истинные молекулярные растворы. Однако для растворов белков характерны некоторые коллоидные свойства: эффект Тендаля (явление светорассеяния), неспособность проходить через полупроницаемые мембраны, высокая вязкость, образование гелей.
Растворимость белка сильно зависит от концентрации солей, то есть от ионной силы раствора. В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов связывается с поверхностью белка и тем самым уменьшается степень его агрегации. При высокой ионной силе ионы солей забирают гидратную оболочку у молекул белка, что приводит к агрегации и выпадению белков в осадок (явление высаливания). Используя различие в растворимости, можно с помощью обычных солей разделить смесь белков.
К числу биологических свойств белков относят в первую очередь их каталитическую активность. Другое важное биологическое свойство белков – их гормональная активность, то есть способность воздействовать на целые группы реакций в организме. Некоторым белкам присущи токсические свойства, патогенная активность, защитные и рецепторные функции, ответственность за явления клеточной адгезии.
Еще одно своеобразное биологическое свойство белков – денатурация. Белки в их естественном состоянии носят название нативных. Денатурация – это разрушение пространственной структуры белков при действии денатурирующих агентов. Первичная структура белков при денатурации не нарушается, но теряется их биологическая активность, а также растворимость, электрофоретическая подвижность и некоторые другие реакции. Радикалы аминокислот, формирующие активный центр белка, при денатурации оказываются пространственно удаленными друг от друга, то есть разрушается специфический центр связывания белка с лигандом. Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков, которые выпадают в осадок.
Реагенты и условия, вызывающие денатурацию белков:
- температура выше 60оС – разрушение слабых связей в белке,
- кислоты и щелочи – изменение ионизации ионогенных групп, разрыв ионных и водородных связей,
- мочевина – разрушение внутримолекулярных водородных связей в резуль-тате образования водородных связей с мочевиной,
- спирт, фенол, хлорамин – разрушение гидрофобных и водородных связей,
- соли тяжелых металлов – образование нерастворимых солей белков с иона-ми тяжелых металлов.
При удалении денатурирующих агентов возможна ренативация, так как пептидная цепь стремится принять в растворе конформацию с наименьшей свободной энергией.
В условиях клетки белки могут самопроизвольно денатурировать, хотя и с меньшей скоростью, чем при высокой температуре. Самопроизвольная ренативация белков в клетке затруднена, так как из-за высокой концентрации существует большая вероятность агрегации частично денатурированных молекул.
В клетках имеются белки – молекулярные шапероны, которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию. Вначале эти белки были обнаружены как белки теплового шока, так как их синтез усиливался при стрессовых воздействиях на клетку, например, при повышении температуры. Шапероны классифицируются по массе субъединиц: hsp-60, hsp-70 и hsp-90. Каждый класс включает семейство родственных белков.
Молекулярные шапероны (hsp-70) высококонсервативный класс белков, находящийся во всех отделах клетки: цитоплазме, ядре, эндоплазматическом ретикулуме, митохондриях. На С-конце единственной полипептидной цепи hsp-70 имеет участок, который представляет собой бороздку, способную взаимодействовать с пептидами длиной 7-9 аминокис-лотных остатков, обогащенных гидрофобными радикалами. Такие участки в глобулярных белках встречаются примерно через каждые 16 аминокислот. Hsp-70 способны защищать белки от температурной инактивации и восста-навливать конформацию и активность частично денатурированных белков.
Шапероны-60 (hsp-60) участвуют в формировании третичной структуры белков. Hsp-60 функционируют в виде олигомерных белков, состоящих из 14 субъединиц. Hsp-60 образуют два кольца, каждое кольцо состоит из 7 субъединиц, соединенных друг с другом.
Каждая субъединица состоит из трех доменов:
- апикальный домен имеет ряд гидрофобных аминокислотных остатков, обращенных внутрь полости, формируемой субъединицами;
- экваториальный домен обладает АТФазной активностью, необходим для высвобождения белка из шаперонинового комплекса;
- промежуточный домен соединяет апикальный и экваториальный домены.
Белок, имеющий на своей поверхности фрагменты, обогащенные гидрофобными аминокислотами, попадает в полость шаперонинового комплекса. В специфической среде этой полости в условиях изолированности от других молекул цитозоля клетки выбор возможных конформаций белка происходит до тех пор, пока не будет найдена энергетически более выгодная конформация. Шаперонзависимое формирование нативной конформации связано с расходованием значительного количества энергии, источником которой служит АТФ.
ЛЕКЦИЯ 7
studopedia.ru
Протеин это:
Протеин Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Содержание
|
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году[1][2], за что в 1962 году они получили Нобелевскую премию по химии.
История изучения
 Антуан Франсуа де Фуркруа, основоположник изучения белков
Антуан Франсуа де Фуркруа, основоположник изучения белков
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы. Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году сотрудником Мульдера Якобом Берцелиусом [3]. Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) почти точно определил молекулярную массу — 131 дальтон. В 1836 Мулдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа протеин (Pr), а теория — теорией протеина [4]. По мере накопления новых данных о белках теория неоднократно подвергалась критике, но до конца 1850-х оставалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков[5]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что фермент уреаза была белком[6].
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов и пищеварительных/метаболических ферментов, которые можно было выделить в местах забоя скота. В конце 1950-х годов компания Armour Hot Dog Co смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков образуется в результате образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Свойства
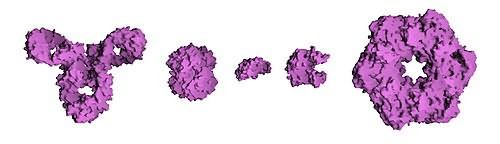 Сравнительный размер белков. Слева направо: Антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)
Сравнительный размер белков. Слева направо: Антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин (другие названия: тайтин, коннектин) — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 кДа, а общая длина 38 138 аминокислот (в человеческой мышце solius[7]).
Белки также являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие боковых цепей основных аминокислот (в первую очередь ω-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды рН, при которой молекула данного белка не несёт электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 считаются основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако некоторых случаях значения лежат в экстремальных областях так, например, для пепсина — протеолетического фермента сильнокислого желудочного сока pI ~ 1[8], а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот часто являются основными белками. Примером таких белков служат гистоны и протамины.
По степени растворимости в воде белки бывают растворимыми (гидрофильные) и нерастворимыми (гидрофобные). К последним относятся большинство входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [9].
Денатурация
 Необратимая денатурация белка куриного яйца под воздействием высокой температуры Основная статья: Денатурация белков
Необратимая денатурация белка куриного яйца под воздействием высокой температуры Основная статья: Денатурация белков
Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и рН, к которым приспособлен данный организм[6]. Резкое изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки[10].
Простые и сложные белки
Основные статьи: Простые белки, Сложные белкиВсе белки разделяют на две большие группы — простые и сложные белки. Простые белки содержат только аминокислоты, сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Примерами простетических групп в составе белков служат гем (в составе гемоглобина), витамины тиамин и биотин. Неорганические простетические группы состоят из ионов металлов — цинка, магния и молибдена [11] .
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует одна или несколько последовательностей из трёх нуклеотидов — так называемых триплетов или кодонов. То, какая аминокислота соответствует данному кодону в мРНК определяется генетическим кодом, который может несколько отличаться у разных организмов.
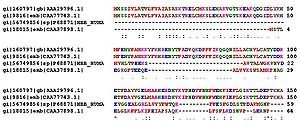 Сравнение аминокислотных последовательностей белков (в данном случае — гемоглобинов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов
Сравнение аминокислотных последовательностей белков (в данном случае — гемоглобинов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов
Гомологичные белки (выполняющие одну функцию и, предположительно, имеющие общее эволюционное происхождение, например, гемоглобины) разных организмов имеют во многих местах цепи различные аминокислотные остатки, называемые вариабельными, в противоположность консервативным, общим остаткам. По степени гомологии возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
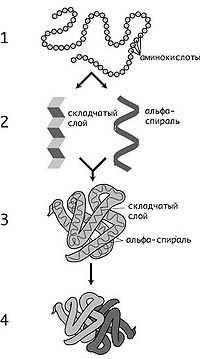 Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Уровни структуры белка
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[12]:
- Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним можно предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Ниже приведены некоторые распространённые типы вторичной структуры белков:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L), хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина, близкорасположенные аспарагин, серин, треонин и лейцин могут стерически мешать образованию спирали, пролин вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
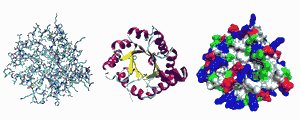 Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображена контактная поверхность белка, на основании Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности активности участков Третичная структура� — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие:
Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображена контактная поверхность белка, на основании Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности активности участков Третичная структура� — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие:
- ковалентные связи (между двумя цистеинами — дисульфидные мостики);
- ионные (электростатические) взаимодействия (между противоположно заряженными аминокислотными остатками);
- водородные связи;
- гидрофобные взаимодействия.
Белки разделяют на группы согласно их трёхмерной структуре. Например, изображённый на картинке справа белок, триозофосфатизомераза, состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным тёхмерным строением называются αβ-баррелы (от англ. barrel — бочка) [1].
Четверичная структура� — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.Также выделяют:
- Трёхмерную структуру белка — набор пространственных координат, составляющих белок атомов.
- Субъединичную (доменную) структуру белка — последовательность участков белка, имеющих известную функцию или определённую трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.
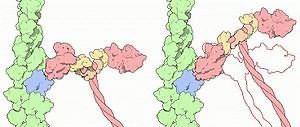
 Изображение модели комплекса бактериальных шаперонов GroES и GroEL (вид сверху). Аггрегированный белок поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структуры
Изображение модели комплекса бактериальных шаперонов GroES и GroEL (вид сверху). Аггрегированный белок поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структуры
Образование и поддержание структуры белков в живых организмах
Основная статья: ШапероныСпособность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. В настоящее время общепризнана теория о том, что в результате эволюции стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида [13].
Тем не менее, в клетках существует группа белков, функция которых — обеспечение восстановления структуры белков после повреждения, а также создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока)[14]. Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона, α-кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за аггрегирования белков и, как результат, к катаракте [15].
Синтез белков
Химический синтез
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют органический синтез — например, химическое лигирование[16]. Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно получить короткий иммунногенный пептид (эпитоп), необходимый для получения антител путём инъекции в животных, или получения гибридо́м; химический синтез также используется для получения ингибиторов некоторых ферментов [17]. Химический синтез позволяет вводить искусственные, то есть не встречающиеся в обычных белках аминокислоты — например, присоединять флюоресцентные метки к боковым цепям аминокислот. Однако химические методы синтеза неэффективны при длине белков более 300 аминокислот; кроме того, искусственные белки могут иметь неправильную третичную структуру, и у аминокислот искусственных белков отсутствуют посттрансляционные модификации.
Биосинтез белков
Основная статья: Биосинтез белкаУниверсальный способ: рибосомный синтез
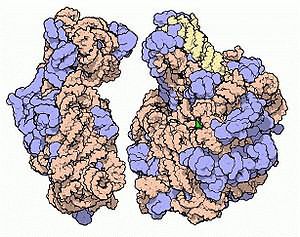 Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы — молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет рРНК
Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы — молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет рРНК
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более, чем одним кодоном. Гены, кодирующие белки сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду [18].
Процесс синтеза белка с мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК рРНК, образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК (рРНК) катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья, и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C- концу.
Нерибосомный синтез
У низших грибов и некоторых бактерий существует менее распространённый способ биосинтеза белков, который не требует участия рибосом. Синтез пептидов, обычно вторичных метаболитов, проводится высокомолекулярным белковым комплексом, так называемой НРС-синтазой. НРС-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи, высвобождение синтезированного пептида и, иногда, домен, способный изомеризовать L-аминокислоты (нормальная форма) в D-форму.[19][20]
Внутриклеточный транспорт и сортировка белков
Основная статья: Внутриклеточная сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, ЭПР, аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определенный компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Посттрансляционная модификация белков
Основная статья: Посттрансляционная модификация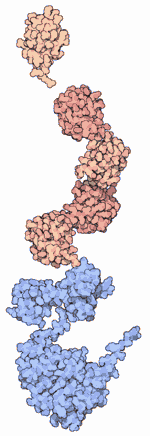 Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src (голубой), предвещая его деградацию
Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src (голубой), предвещая его деградацию
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:
- присоединение различных функциональных групп (ацетил-, метил- и фосфатных групп);
- присоединение липидов и углеводородов;
- изменение стандартных аминокислот на нестандартные (образование цитруллина);
- образование структурных изменений (образование дисульфидных мостиков между цистеинами);
- удаление части белка как в начале (сигнальная последовательность), так и в отдельных случаях в середине (инсулин);
- добавление небольших белков, которые влияют на деградацию белков (сумоилирование и убиквитинирование).
При этом тип модификации может быть как универсальным (добавление цепей, состоящих из мономеров убиквитина, служит сигналом для деградации этого белка протеосомой), так и специфическим для данного белка [21]. В то же время один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в состав хроматина у эукариот) в разных условиях могут подвергаться до 150 различных модификаций [22].
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, и участвуют в каждом внутреннем процессе клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл или секретируются во внеклеточное пространство для обмена сигналами между клетками и гидролиза пищевых субстратов. Следует отметить, что классификация белков по их функции достаточно условна, потому что у эукариот один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК синтетаз, который не только присоединяет лизин к тРНК, но и регулирует транскрипцию нескольких генов[23].
 Молекулярная модель фермента уреазы бактерии Helicobacter pylori
Молекулярная модель фермента уреазы бактерии Helicobacter pylori
Каталитическая функция
Основная статья: ФерментыНаиболее хорошо известная роль белков в организме — катализ различных химических реакций. Ферменты — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации и репарации ДНК и синтезе РНК. Известно несколько тысяч ферментов; среди них такие, как например пепсин, расщепляют белки в процессе пищеварения. В процесс пострансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками[24]. Ускорение реакции в результате ферментативного катализа иногда огромно: например, реакция, катализируемая ферментом оротат-карбоксилазой протекает в 1017 быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента)[25]. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются субстратами.
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и еще меньшее количество — в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности — напрямую участвуют в катализе[26]. Часть фермента, которая присоединяет субстрат и содержит каталитические аминокислоты, называется активным центром фермента.
Структурная функция
Основная статья: Фибриллярные белкиСтруктурные белки, как своего рода арматура, придают форму жидкому внутреннему содержимому клетки. Большинство структурных белков являются филаментозными белками: например, мономеры актина и тубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму[27]. Коллаген и эластин — основные компоненты соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
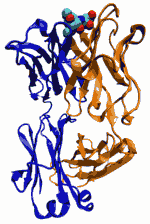 Мышиное антитело против холеры, присоединённое к углеводородному антигену (вверху)
Мышиное антитело против холеры, присоединённое к углеводородному антигену (вверху)
Защитная функция
Основная статья: АнтителаСуществуют несколько видов защитных функций белков:
- Физическая защита. В ней принимает участие коллаген, белок, поддерживающего структуру кожи. Состоит из хондроитина и глюкозамина.
- Химическая защита. Связывание химических токсинов белковыми молекулами — дезинтоксикация.
- Иммунная защита. Защита с помощью иммуноглобулинов
Белки, входящие в состав крови, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов. Примерами первой группы белков служат фибриногены и тромбины[28], участвующие в свёртывании крови, а антитела (иммуноглобулины), нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами[29]. В то время как ферменты имеют ограниченное сродство к субстрату, поскольку слишком сильное присоединение к субстрату может мешать протеканию катализируемой реакции, стойкость присоединения антител к антигену ничем не ограничено [30].
Регуляторная функция
Основные статьи: Цитокины, Активатор (белки), Протеасома, Регуляторная функция белковМногие процессы в организме регулируются небольшими белковыми молекулами, полипептидными гормонами и цитокинами. Примером таких белков служит, соответственно, инсулин, который регулирует концентрацию глюкозы в крови, и фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма[31]. На внутриклеточном уровне транскрипция генов определяется присоединением факторов транскрипции — белков-активаторов и белков-репрессоров к регуляторным последовательностям генов. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов [32], а деградация РНК и белков также проводится специализированными белковыми комплексами [33]. Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
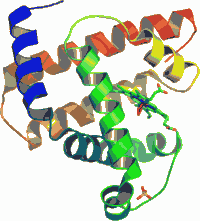 Структура миоглобина с выделенными α спиралями.
Структура миоглобина с выделенными α спиралями.
Транспортная функция
Основная статья: Транспортные белкиРастворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (афинность) к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов [34].
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные транспортные белки принято подразделять на белки-каналы и белки-переносчики. Белки-каналы содержат внутренние заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться внутрь или наружу. Многие ионные каналы специализируются на транспорте только одного иона; так, калиевые и натриевые каналы часто различают эти сходные ионы и пропускают только один из них [35]. Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» — АТФ-синтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам [36].
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Рецепторная функция
Основная статья: Клеточный рецепторБелковые рецепторы могут как находиться в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, который с помощью конформационных изменений передаётся на другую часть молекулы, активирующую передачу сигнала на другие клеточные компоненты. У мембранных рецепторов часть молекулы, связывающаяся с сигнальной молекулой, находится на поверхности клетки, а домен, передающий сигнал, внутри [37].
 Движение молекулы миозина при мышечном сокращении
Движение молекулы миозина при мышечном сокращении
Моторная и сократительные функции
Целый класс моторных белков обеспечивает движения организма (например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), а также активный и направленный внутриклеточный транспорт (кинезин, динеин). Динеины и кинезины проводят транспортировку молекул (так называемого карго) вдоль микротрубочек с использованием гидролиза АТФ в качестве источника энергии. Динеины переносят карго из периферических частей клетки по направлению к центросоме, кинезины в противоположном направлении [38][39]. Цитоплазматические варианты миозина могут перемещать карго вдоль микрофиламентов.
Белки в обмене веществ
Большинство микроорганизмов и растений могут синтезировать 20 стандартных аминокислот, а также дополнительные (нестандартные) аминокислоты, например, цитруллин. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей[40].
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии[41]. Аминокислоты также являются важным источником азота в питании организма.
В мире не существует единых представлений о количественной характеристике норм потребления белков. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Методы количественного определения белков
Для определения количества белка в образце используется ряд методик:
- Биуретовый метод
- Микробиуретовый метод
- Метод Бредфорда
- Метод Лоури
- Спектрофотометрический метод
См. также
- Аминокислота
- Незаменимые аминокислоты
- Нестандартные аминокислоты
- Пептидная связь
- Пептиды
- Прионы
- Протеомика
- Сплайсинг белков
- Folding@home — проект распределённых вычислений для проведения компьютерной симуляции свёртывания молекул белка
Ссылки
- Свойства аминокислот и белков
- PDB — Protein Data Bank
- Обзоры статей о фолдинге белков на русском
- Хаос и порядок дискретных систем в свете синергетической теории информации (В статье проводится количественный анализ первичной структуры белков со стороны соотношения хаоса и порядка)
Литература
- Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. — М.: Мир, 1994. — ISBN 5-03-001986-3
- Ленинджер А. Основы биохимии. В 3 томах. — М.: Мир, 1985.
- Страйер Л. Биохимия. В 3 томах. — М.: Мир, 1984.
Примечания
- ↑ Muirhead H., Perutz M. Структура гемоглобина. = Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 A resolution. // Nature : журнал. — 1963. — Т. 199. — № 4894. — С. 633—638.
- ↑ Kendrew J., Bodo G., Dintzis H., Parrish R., Wyckoff H., Phillips D. Трёхмерная модель молекулы миоглобина, полученная по результатам рентгеновских исследований. = A three-dimensional model of the myoglobin molecule obtained by x-ray analysis. // Nature : журнал. — 1958. — Т. 181. — № 4610. — С. 662—666.
- ↑ Leicester, Henry . «Berzelius, Jöns Jacob». Dictionary of Scientific Biography 2. New York: Charles Scribner’s Sons. 90-97 (1980). ISBN 0684101149
- ↑ Биоорганическая химия. — Просвещение, 1987.
- ↑ Белки // Химическая энциклопедия. — Советская энциклопедия, 1988.
- ↑ 1 2 N. H. Barton, D. E. G. Briggs, J. A. Eisen «Evolution», Cold Spring Harbor Laboratory Press, 2007 — P. 38. ISBN 978-0879696849
- ↑ Fulton A, Isaacs W (1991). "Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis". Bioessays 13 (4): 157-61. PMID 1859393.
- ↑ http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.4.23.1
- ↑ S J Singer. The Structure and Insertion of Integral Proteins in Membranes. Annual Review of Cell Biology. Volume 6, Page 247—296. 1990
- ↑ Страер Л., Биохимия в 3 томах. — М.: Мир, 1984
- ↑ de Bolster, M.W.G. Glossary of Terms Used in Bioinorganic Chemistry: Prosthetic groups. International Union of Pure and Applied Chemistry (1997). Проверено 30 октября 2007.
- ↑ Ленинджер А. Основы биохимии, в 3 томах. — М.: «Мир», 1985.
- ↑ Anfinsen C. (1973). "Principles that Govern the Folding of Protein Chains.". Science 181: 223-229.
- ↑ Ellis RJ, van der Vies SM (1991). "Molecular chaperones". Annu. Rev. Biochem. 60: 321-47. DOI:10.1146/annurev.bi.60.070191.001541. PMID 1679318.
- ↑ Sun Y, MacRae TH. (2005). "The small heat shock proteins and their role in human disease.". FEBS J. 60: 2613-27. PMID 115943797.
- ↑ Wilken J, Kent SB.. Curr Opin Biotechnol. Chemical protein synthesis. 1998.9(4):412-26
- ↑ Dawson PE, Kent SB. Synthesis of native proteins by chemical ligation. Annu Rev Biochem. 2000;69:923-60
- ↑ Dobson CM. (2000). The nature and significance of protein folding. In Mechanisms of Protein Folding 2nd ed. Ed. RH Pain. Frontiers in Molecular Biology series. Oxford University Press: New York, NY.
- ↑ Stack D, Neville C, Doyle S. Nonribosomal peptide synthesis in Aspergillus fumigatus and other fungi. Microbiology. 2007 May;153(Pt 5):1297-306
- ↑ Welker M, von Döhren H. Cyanobacterial peptides — nature’s own combinatorial biosynthesis. FEMS Microbiol Rev. 2006 Jul;30(4):530-63
- ↑ Demartino GN, Gillette TG. Proteasomes: machines for all reasons. Cell. 2007 May 18;129(4):659-62
- ↑ Bronner C, Chataigneau T, Schini-Kerth VB, Landry Y.The «Epigenetic Code Replication Machinery», ECREM: a promising drugable target of the epigenetic cell memory. Curr Med Chem. 2007;14(25):2629-41
- ↑ Yannay-Cohen N, Razin E. (2000). "Translation and transcription: the dual functionality of LysRS in mast cells.". Mol Cells. 22: 127-32. PMID 17085962.
- ↑ Bairoch A. (2000). "The ENZYME database in 2000". Nucleic Acids Res 28: 304-305. PMID 10592255.
- ↑ Radzicka A, Wolfenden R. (1995). "A proficient enzyme.". Science 6 (267): 90-931. PMID 7809611.
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute
- ↑ Erickson HP. Evolution of the cytoskeleton. Bioessays. 2007:668-77
- ↑ Wolberg AS (2007). «Thrombin generation and fibrin clot structure.». Blood Rev. 21 (3): 131-42.PMID 17208341.
- ↑ ^ J. Li, D.R. Barreda, Y.-A. Zhang, H. Boshra, A.E. Gelman, S. LaPatra, L. Tort & J.O. Sunyer (2006). «B lymphocytes from early vertebrates have potent phagocytic and microbicidal abilities». Nature Immunology 7: 1116—1124. PMID 16980980.
- ↑ Felix NJ, Allen PM. Specificity of T-cell alloreactivity. Rev Immunol. 2007 Dec;7(12):942-53
- ↑ Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндоктринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6
- ↑ Hinnebusch AG. Translational regulation of GCN4 and the general amino acid control of yeast. Annu Rev Microbiol. 2005;59:407-50
- ↑ Anderson P, Kedersha N., RNA granules. Cell Biol. 2006:172(6):803-8
- ↑ Wittenberg JB. On optima: the case of myoglobin-facilitated oxygen diffusion Gene. 2007 Aug 15;398(1-2):156-61.
- ↑ Driessen AJ, Nouwen N. Protein Translocation Across the Bacterial Cytoplasmic Membrane.Annu Rev Biochem. 2007 Dec 13 [Epub ahead of print]
- ↑ Drory O, Nelson N. (2006). "The emerging structure of vacuolar ATPases.". Physiology (Bethesda). 21: 317-25. PMID 16990452.
- ↑ Dupré DJ, Hébert TE. Biosynthesis and trafficking of seven transmembrane receptor signalling complexes.Cell Signal. 2006.(10):1549-59
- ↑ Karp G. Cell and Molecular Biology: Concepts and Experiments, Fourth ed, pp. 346—358. John Wiley and Sons, Hoboken, NJ. 2005.
- ↑ Schroer, Trina A. Dynactin. Annual Review of Cell and Developmental Biology 2004 20, 759—779. PMID 15473859
- ↑ Voet D, Voet JG. Biochemistry Vol 1 3rd ed., Hoboken, NJ.(2004).
- ↑ Brosnan J (2003). "Interorgan amino acid transport and its regulation". J Nutr 133 (6 Suppl 1): 2068S-72S. PMID 12771367.
Аминокислоты · Пептиды · Белки · Углеводы · Нуклеотиды · Нуклеиновые кислоты · Липиды · Терпены · Каротиноиды · Стероиды · Флавоноиды · Алкалоиды · Гликозиды
� �Wikimedia Foundation. 2010.
dic.academic.ru
/ 3 Белки определение, характеристика, роль
БЕЛКИ, высокомол. прир.полимеры, построенные из остатковаминокислот, соединенных амидной (пептидной) связью —СО—NH—. Каждый Б. характеризуется специфич.аминокислотной последовательностьюи индивидуальной пространств, структурой (конформацией). На долю Б. приходится не менее 50% сухой массы орг. соед. животнойклетки. Функционирование Б. лежит в основе важнейших процессов жизнедеятельностиорганизма. Обмен в-в (пищеварение,дыханиеи др.), мышечное сокращение, нервная проводимость и жизньклеткив целом неразрывно связаны сактивностьюферментов- высокоспецифич.катализаторовбиохим. р-ций, являющихсябелками. Основу костной и соединительнойтканей, шерсти, роговых образований составляют структурные Б. (см., напр., Коллаген). Они же формируют остов клеточных органелл (митохондрий,мембрани др.). Расхождениехромосомприделенииклетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (см., напр.,Актин, Миозин). Важную группу составляютрегуляторные белки, контролирующиебиосинтезБ. и нуклеиновых к-т. К регуляторным Б. относятся также пептидно-белковыегормоны, к-рые секретируются эндокриннымижелезами. Информация о состоянии внеш. среды, разл. регуляторные сигналы (в т. ч. гормональные) воспринимаютсяклеткойс помощью спец.рецепторных белков, располагающихся на наружной пов-сти плазматич.мембраны. Эти Б. играют важную роль в передаче нервного возбуждения и в ориентированном движенииклетки(хемотаксисе). В активном транспортеионов,липидов,Сахаровиаминокислотчерез биол.мембраныучаствуют транспортные Б., или белки-переносчики. К последним относятся такжегемоглобинимиоглобин, осуществляющие переноскислорода. Преобразование и утилизация энергии, поступающей ворганизмс питанием, а также энергии солнечного излучения происходят при участии Б. биоэнергетич. системы (напр.,родопсин, цитохромы). Большое значение имеют пищевые и запасныебелки(см., напр.,Казеин, Проламины), играющие важную роль в развитии и функционированииорганизмов. Защитные системы высшихорганизмовформируются защитными Б., к к-рым относятсяиммуноглобулины(ответственны за иммунитет), Б.комплемента(ответственны зализисчужеродныхклетоки активацию иммунологич. ф-ции), Б. системысвертывания крови(см., напр.,Тромбин, Фибрин)и противовирусный Б.интерферон.
По составу Б. делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионыметалла(металлопротеиды) илипигмент(хромопротеиды), образовывать прочные комплексы слипидами(липопротеины), нуклеиновыми к-тами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной к-ты (фосфопротеиды),углевода(гликопротеины)или нуклеиновой к-ты (геномы нек-рых вирусов). В соответствии с формоймолекулБ. подразделяют на глобулярные и фибриллярные.Молекулыпервых свернуты в компактные глобулы сферич. или эллипсоидной формы,молекулывторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных Б., в отличие от фибриллярных, растворимы вводе. Особую группу составляют мембранные (амфипатические) Б., характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков вмолекуле: погруженная в биол.мембранучасть глобулы состоит преим. из липофильных аминокислотных остатков, а выступающая измембраны- из гидрофильных.
Синтез.БиосинтезБ. происходит в результатетрансляциив субклеточных частицах -рибосомах, представляющих собой сложный рибонуклеопротеидный комплекс. Информация о первичной структуре Б. "хранится" в соответствующихгенах- участкахДНК- в виде последовательностинуклеотидов. В процессетранскрипцииэта информация с помощьюфермента- ДНК-зависимой РНК-полимеразы - передается на матричную рибонуклеиновую к-ту, к-рая, соединяясь срибосомой, служитматрицейдля синтеза Б. Выходящие изрибосомысинтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному Б. конформацию, а также подвергаются модификации благодаря р-циям разл.функциональных группаминокислотных остатков и расщеплениюпептидных связей(см. Модификация белков).
Хим. синтез широко применяют для получения пептидов, в т.ч. биологически активныхгормонови их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биол. функции, а такжепептидов, несущих антигенные детерминанты разл. Б. и применяемых для приготовления соответствующих вакцин. Первые хим. синтезы Б. в 60-е гг. (инсулина овцы ирибонуклеазыSX осуществленные в р-ре с помощью тех же методов, к-рые используют при синтезепептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни хим. р-ций и окончательный выход Б. был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы нек-рые химически чистые Б., в частностиинсулин человека(П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В. Т. Иванов). Однако досихпор хим. синтез Б. представляет весьма сложную проблему и имеет скорее теоретич., чем практич. значение. Более перспективны методыгенетической инженерии, к-рые позволяют наладить пром. получение практически важных Б. ипептидов.
StudFiles.ru
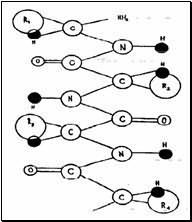
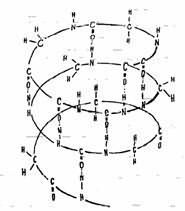
 Электрический ток определение
Электрический ток определение Административное право определение
Административное право определение Автомобиль определение
Автомобиль определение 3 Закон ньютона определение
3 Закон ньютона определение Акт определение
Акт определение Анкета определение
Анкета определение Вопросы определения
Вопросы определения Бетон определение
Бетон определение Брак это определение в производстве
Брак это определение в производстве Власть определение
Власть определение Война определение
Война определение