Работа 30. Количественное определение аскорбиновой кислоты
Раздел 5. Витамины
Контрольные вопросы
1. Что такое нуклеиновая кислота, и как она построена?
2. Что такое ДНК и РНК? Виды РНК.
3. Каков принцип выделения из ткани ДНК и ее обнаружения?
4. Качественные реакции на составные части нуклеиновых кислот.
5. Что представляют собой мононуклеотиды? Каковы продукты их гидролиза? Написать реакцию гидролиза мононуклеотида (формулами).
6. Как соединяются между собой мононуклеотиды в молекуле нуклеиновых кислот? Напишите формулу динуклеотида.
Витамины – низкомолекулярные органические вещества, имеющие разнообразную химическую природу. Они условно объединены в одну группу по признаку жизненной необходимости для организма. Поскольку в организме человека и животных витамины не синтезируются, за исключением некоторых из них, образующихся симбиотической микрофлорой пищеварительного тракта, они относятся к незаменимым факторам питания. Поступая в организм в небольших количествах с пищей, витамины обеспечивают нормальное протекание биохимических процессов и, таким образом, участвуют в регуляции многих метаболических функциях организма.
Биологическая роль большинства витаминов заключается в том, что многие витамины входят в состав простетических групп ферментов. Недостаточное поступление витаминов с пищей, а также нарушение их всасывания в организме приводит к развитию тяжелых нарушений обмена веществ: авитаминозам и гиповитаминозам.
Заболевание, возникающее в результате отсутствия того или иного витамина, называют авитаминозом. При относительной недостаточности какого-либо витамина наблюдается гиповитаминоз. Поскольку функции витаминов тесно связаны между собой, то обычно наблюдаются полиавитаминозы или полигиповитаминозы. Авитаминозы встречаются достаточно редко, чаще встречаются гиповитаминозы как результат нерационального питания, нарушения обмена веществ или перенесенных заболеваний и лекарственной терапии (антибиотиков и сульфамидов). Избыточный прием ряда витаминов приводит к нарушениям метаболических функций – гипервитаминозу.
Простейшая классификация витаминов основана на их физико-химических свойствах, в частности на растворимости. По этому признаку витамины делят на две группы: а) витамины, растворимые в воде; б) витамины, растворимые в жирах и органических растворителях. К водорастворимым витаминам относятся витамины группы В (В1, В2, В6, В9, В12), витамин РР, витамин Н, витамин С, витамин Р, пантотеновая кислота и витаминоподобные вещества – холин, инозит, пангамовая, липоевая, парааминобензойная кислоты, витамин U, коэнзим Q. К жирорастворимым витаминам относятся витамины группы А, витамины группы D, витамины группы Е, витамины группы К, непредельные жирные кислоты, имеющие две и более двойных связей. Антивитамины – вещества, уменьшающие биологическую активность ферментов, являются или структурными аналогами витаминов и конкурентно препятствуют образованию активных форм ферментов, или ферментами, разрушающими витамины.
Для открытия и обнаружения витаминов в пищевых продуктах или других биологических объектах обычно пользуются качественными реакциями, основанными на образовании характерной цветной реакции какого-либо витамина с соответствующим химическим реактивом.
Биологическая роль аскорбиновой кислоты в организме разнообразна. Она принимает участие в окислительно-восстановительных процессах и связана с системой глютатиона. Аскорбиновая кислота участвует в синтезе стероидных гормонов в коре надпочечников и необходима для процесса гидроксилирования как фактор для проявления действия ферментов гидроксилаз. Она участвует в образовании тетрагидрофолиевой кислоты из фолиевой кислоты, в гидроксилировании лизина в оксилизин, пролина в оксипролин, необходимых для образования коллагеновых волокон; ускоряет всасывание железа, активирует фермент желудочного сока пепсиноген, что особенно важно при недостатке соляной кислоты в желудочном соке.
Принцип метода. Количественный метод определения аскорбиновой кислоты основан на способности витамина С восстанавливать 2,6-дихлорфенолиндофенол, который в кислой среде имеет красную окраску, в щелочной – синюю, а при восстановлении обесцвечивается.
Для предохранения витамина С от разрушения исследуемый раствор титруют в кислой среде щелочным раствором 2,6-дихлорфенолиндофенола до появления розового окрашивания.
Исследуемый материал: хвоя, капуста, морковь, картофель, моча.
Реактивы: 0,001 н раствор натриевой соли 2,6-дихлорфенолиндофенола, 10%-ный раствор НСl.
Оборудование: весы аптечные; мерные цилиндры; пипетки на 1, 2, 5 мл; фарфоровые ступки с пестиками; бюретка; колбочки для титрования; ножницы; скальпель; стеклянный песок.
ХОД РАБОТЫ. 1. Определение содержания витамина С в капусте. Отвешивают 1 г капусты, растирают в ступке с 2 мл 10%-го раствора НСl и стеклянным песком, приливают 8 мл воды и фильтруют. Отбирают для титрования 2 мл фильтрата, добавляют 10 капель 10%-го раствора НСl и титруют 2,6-дихлорфенолиндофенолом до розовой окраски. Вычисляют содержание аскорбиновой кислоты в 100 г капусты.
Для расчета содержания аскорбиновой кислоты используют формулу:
0,088 · А · Г · 100
х = ------------------------
Б · В ,
где х – содержание аскорбиновой кислоты в миллиграммах на 100 г продукта, 0,088 – содержание аскорбиновой кислоты, мг, А – количество титранта, мл, Б – объем экстракта, взятый для титрования, мл, В – количество продукта, взятое для анализа, г, Г – общее количество экстракта, 100 – пересчет на 100 г продукта.
В 100 г капусты содержится 25-100 мг аскорбиновой кислоты, в 100 г шиповника – 500-1500 мг, в 100 г хвои – 200-400 мг.
2. Определение содержания витамина С в картофеле. Отвешивают 5 г картофеля, растирают в ступке со стеклянным песком и 20 каплями 10%-го раствора НСl (чтобы картофель не темнел). Постепенно приливают 15 мл дистиллированной воды. Полученную массу сливают в стаканчик, ополаскивают ступку 2 мл воды, сливают воду в колбочку и титруют 2,6-дихлорфенолиндофенолом до розовой окраски. Рассчитывают содержание аскорбиновой кислоты. В 100 г картофеля содержится 1-5 мг витамина С.
3. Определение содержания витамина С в моче. Определение содержания витамина С в моче дает представление о запасах этого витамина в организме, так как наблюдается соответствие между концентрацией витамина С в крови и количеством этого витамина, выделяемым с мочой. Однако при гиповитаминозе С содержание аскорбиновой кислоты в моче не всегда понижено. Часто оно бывает нормальным, несмотря на большой недостаток этого витамина в тканях.
У здоровых людей введение per os 100 мг витамина С быстро приводит к повышению его концентрации в крови и моче. При гиповитаминозе С ткани, испытывающие недостаток в витамине, задерживают принятый витамин и его концентрация в моче не повышается. Моча здорового человека содержит 20-30 мг витамина С или 113,55-170,33 мкмоль/сут. У детей уровень этого витамина понижается при цинге, а также острых и хронических инфекционных заболеваниях.
В стаканчик или колбочку отмеривают 10 мл мочи и 10 мл дистиллированной воды, перемешивают, подкисляют 20 каплями 10%-го раствора НСL и титруют 0,001 н раствором 2,6-дихлорфенолиндофенолом до розовой окраски. Расчет содержания аскорбиновой кислоты в моче производят по формуле:
0,088 · А · В
х =-----------------
Б ,
где х – содержание аскорбиновой кислоты, мг/сут, 0,088 – коэффициент, мг, А – количество титранта, мл, Б – объем мочи, взятой для титрования, мл, В – среднее суточное количество мочи (для мужчин – 1500 мл, для женщин – 1200 мл).
studopedia.ru
Работа 79. Количественное определение аскорбиновой кислоты в лекарственных растениях
Реактивы. Соляная кислота, 2%-ный раствор; 2,6-дихлорфенолиндофенол, 0,001 М раствор.
Оборудование. Пипетки вместимостью 5 и 10 мл; мерная колба вместимостью 100 мл; воронка; вата; аптечные весы с разновесами; микробюретка; скальпель; ступки с пестиком; стаканчики для титрования.
Материал.
-
Лекарственное сырье (цветы бузины и тысячелистника, лист крапивы и сенны, кора крушины, витаминный чай, плоды шиповника).
-
Таблетки из плодов аронии черноплодной.
Метод основан на способности аскорбиновой кислоты к окислительно-восстановительным превращениям. В ходе окисления аскорбиновой кислоты происходит восстановление 2,6-дихлорфенолиндофенола с образованием его лейкоформы. На полное окисление аскорбиновой кислоты в растворе указывает появление розового окрашивания при небольшом избытке 2,6-дихлорфенолиндофенола в кислой среде:
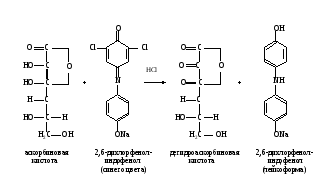
Ход определения. На аптечных весах берут навески лекарственного сырья: цветы бузины, лист крапивы, цветы тысячелистника, кора крушины, лист сенны, витаминный чай и плоды аронии черноплодной (или таблетки) по 0,5 г; шиповник, очищенный от семян, - 0,2 г. Исследуемый материал переносят в ступку, измельчают скальпелем и растирают в ступке с 5 мл раствора соляной кислоты.
Вытяжку фильтруют через тонкий слой ваты в мерную колбу, вместимостью 100 мл. Извлечение витамина С из той же навески повторяют три раза с таким же объемом соляной кислоты, фильтруя каждый раз полученную вытяжку в ту же мерную колбу. Содержимое колбочки доводят до метки дистиллированной водой, перемешивают.
Для определения отбирают 10 мл вытяжки в стаканчик и титруют содержимое раствором 2,6-дихлорфенолиндофенола, налитого в микробюретку, до появления розового окрашивания, не исчезающего в течение 30 с.
Расчет проводят по формуле:
0,088V100·1000
х = —————————— ,
10b
где х – содержание аскорбиновой кислоты, мг/кг;
0,088 – масса аскорбиновой кислоты, соответствующая 1 мл 0,001 М раствора 2,6-дихлорфенолиндофенола, мг;
100 – разведение взятой пробы;
1000 – коэффициент пересчета на 1 кг сырья;
10 – объем жидкости, взятый для титрования, мл;
V – объем 2,6-дихлорфенолиндофенола, пошедший на титрование, мл;
b – навеска исследуемого материала, г.
Оформление работы. Полученные данные оформить в виде таблицы и сделать вывод о значении исследованного растительного материала как источника аскорбиновой кислоты. Указать в выводе о целесообразности применения растительного сырья с целью профилактики С-витаминной недостаточности.
|
Материал |
Навеска, г |
Объем 2,6-дихлорфенолиндофенола, пошедшего на титрование, мл |
Содержание аскорбиновой кислоты, мг/кг |
Практическое значение работы. Определение содержания аскорбиновой кислоты в пищевых продуктах и лекарственных растениях необходимо для составления правильного рациона, удовлетворяющего потребность организма в этом витамине. Богаты витамином С плоды шиповника, черной смородины, цитрусовых и т.д. Аскорбиновая кислота применяется для профилактики гиповитаминоза и простудных заболеваний, для лечения воспалительных процессов, атеросклероза. Она способствует усилению регенеративных процессов. Определение аскорбиновой кислоты в крови и моче используется для выявления состояния гиповитаминоза. Аскорбиновая кислота участвует в окислительно-восстановительных процессах при синтезе стероидных гормонов, обмене ароматических аминокислот, образовании соединительной ткани.
StudFiles.ru
4.2.3. Анализ уф-спектров кислоты аскорбиновой
Наличие сложных сопряженных систем в структурах водорастворимых вита-минов дает возможность широкого применения УФ-спектрофотометрии для их фармакопейного анализа. IP и USP регламентируют при установлении подлинности сравнение УФ-спектров испытуемой субстанции со спектрами стандартных образцов. ГФ, CP, EP (BP) и JP при установлении подлинности регламентируют сравнение УФ-спектров испытуемой субстанции со стандартными спектрами (рис. 7).
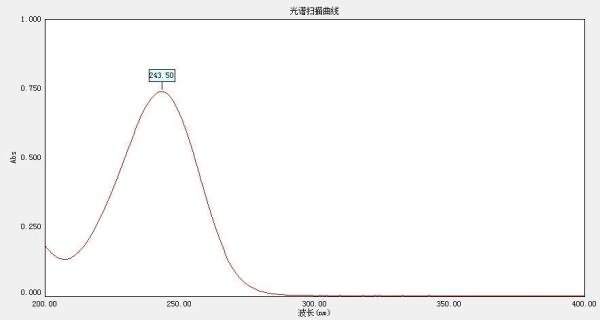
Рис.7. УФ-спектр кислоты аскорбиновой (15 мкг/мл) в растворе кислоты серной 0,005 М.
-
Количественное определение кислоты аскорбиновой.
5.1. Титриметрические методы
Титриметрические количественного определения кислоты аскорбиновой также базируются на ее химических свойствах:восстановительных и кислотных.
-
ГФ XIIрекомендует метод йодатометрии. В этом случае титрантом служит раствор калия йодата. Титрование ведут в присутствии иодида калия и хлороводородной кислоты (индикатор — крахмал) до стойкого синего окрашивании.

Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
![]()
-
Метод йодометрии. Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой.
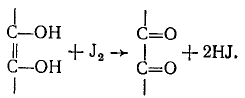
-
Метод йодохлорометрии. Титруют раствором йодмонохлорида до появления стойкого слабо-синего окрашивания (индикатор крахмал). Происходит окисление аскорбиновой кислоты пореакции:

![]()
-
Цериметрическое определение. Избыточная капля сульфата церия окисляет индикатор до бледно-голубого окрашивания
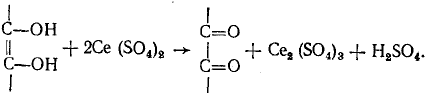
Раствор фенантролина представляет собой комплексное соединение закисного железа с о-фенантролином интенсивно-красного цвета. Сульфат церия окисляет железо до трехвалентного. В результате чего образуется комплексное соединение голубого цвета:
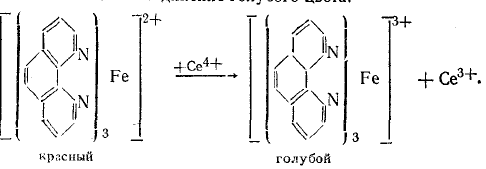
-
Титрование раствором 2,6-дихлорфенолиндофенолята натрия. В плодах шиповника содержание аскорбиновой кислоты определяют титро- ванием 0,001 н. раствором 2,6-дихлорфенолиндофенолята натрия в кислой среде до появления не исчезающей в течение 0,5—1 мин розовой окраски.
-
Кислотные свойства кислоты аскорбиновой выражены в достаточной степени, что позволяет количественно определять лекарственное вещество алкалиметрически. Кислота аскорбиновая титруется стандартным 0,1 М раствором натрия гидроксила, как одноосновная кислота по енольному гидроксилу в 3-ем положении:
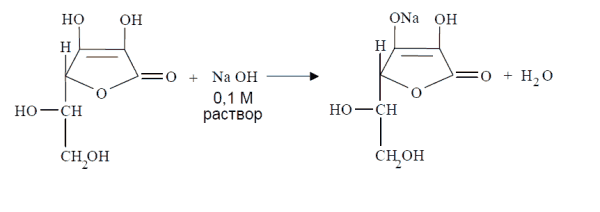
-
Физико-химические методы
Для количественной оценки кислоты аскорбиновой в многокомпонентных образцах со сложной матрицей, следует применять только высокоспецифичные или сепарационные методы анализа. Метод КЭ является дополнением и в то же время, альтернативой ВЭЖХ, характеризуется высокой эффективностью, малым расходом недорогих реагентов и простотой эксплуатации, капилляры долговечны и легко регенерируются. Несомненно, как и любой инструментальный метод, метод КЭ предполагает материальные затраты на приобретение оборудования, однако такое оборудование является универсальным. Предложенная методика КЭ может быть использована для контроля качества лекарственного растительного сырья и лекарственных препаратов, содержащих кислоту аскорбиновую (плоды и сироп шиповника, витаминный сбор №2, листья бархатцев, растворов кислоты аскорбиновой для инъекций и препарата «Аскорутин»).
Для количественного определения кислоты аскорбиновой в инъекционных растворах можно используют более дешевый и доступный спектрофотометрический метод с ФМК.
В большинстве современных лабораторий используют следующие методы количественного определения кислоты аскорбиновой:
-
Оптические методы
-
Спектрофотометрический метод на основании свободной кислоты фосфорномолибденовой.
-
Высокоспецифичный спектрофотометрический ферментативный метод на основе аскорбатоксидазы
-
Хроматографические методы
-
Метод ВЭЖХ
-
Капиллярный зональный электрофорез
-
Мицеллярная электрофонетическая хроматография.
-
Фармакологическое действие, применение в медицине и хранение лекарственных препаратов глюкозы.
StudFiles.ru
Экзаменационный билет №22
1. Комплекс испытаний, применяемых для оценки качества кислоты аскорбиновой в виде 5% раствора для инъекций, а также лекарственных форм внутриаптечного изготовления предусматривает применение в качестве реагентов соединений йода (растворы йода и калия йодата). В соответствии с химической структурой лекарственного средства дайте обоснование выбору и использованию данных реагентов в аналитическом контроле кислоты аскорбиновой:
Исходя их химического строения и свойств кислоты аскорбиновой, объясните способность ее реагировать с раствором йода и калия йодата.
Предложите другие реакции для идентификации лекарственного препарата и укажите степень их специфичности.
Рассмотрите применение 0,1М раствора йода в количественном определении кислоты аскорбиновой на примере лекарственной прописи состава:
Кислоты аскорбиновой 0,1
Кислоты никотиновой 0,05
Сахара 0,25
Предложите способ количественного определения кислоты никотиновой с учетом присутствия в смеси второго компонента.
Укажите значение молярной массы эквивалента для обоих веществ и формулы для расчета их содержания.
Объясните сущность йодатометрического титрования кислоты аскорбиновой в растворе для инъекций и необходимость применения при этом раствора формальдегида. Как отразится на результате анализа его отсутствие? Укажите значение молярной массы эквивалента.
Ответ
Acidum ascorbinicum
V itaminum C
itaminum C
Кислота аскорбиновая
Витамин С
Ascorbic Acid
Функциональные группы: лактонная группировка, спиртовые гидроксильные группы, енольные гидроксильные группы, два оптически активных атома углерода (хиральные центры).
Подлинность: 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС).
2. УФ-спектр ( max зависит от рН среды: при рН 7 λ=265 nm, при рН 2 – λ=243 nm)
3. Тпл.=190°C-193°C ( с разложением). Из-за нестойкости препарата при нагревании для определения Тпл. его предварительно сушат при температуре 60°C в течение 2 часов. Скорость подъема температуры - 5°C в 1 минуту (по той же причине).
4. Удельное вращение (от +22° до +24°) - 2% водный раствор.
ГФ Х регламентирует в качестве испытания на подлинность следующие реакции:
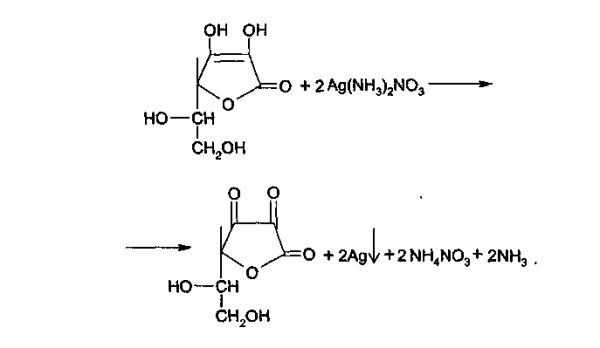
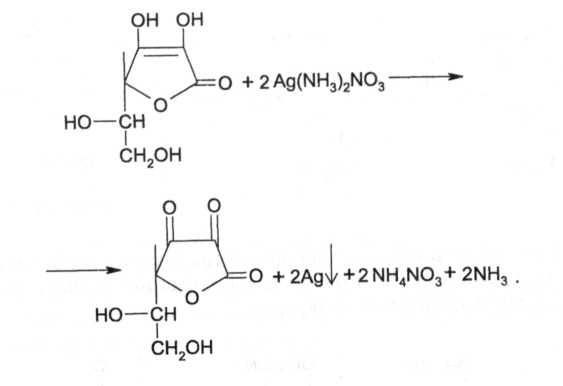
5. Реакция «Серебряного зеркала»: к раствору препарата приливают раствор серебра нитрата, происходит окисление кислоты аскорбиновой до кислоты дегидроаскорбиновой). Образуется темный осадок металлического серебра.
6. Реакция с 2,6-дихлорфенолиндофенолятом. К препарату добавляют указанный реактив, происходит восстановление реагента и синее окрашивание реагента исчезает.
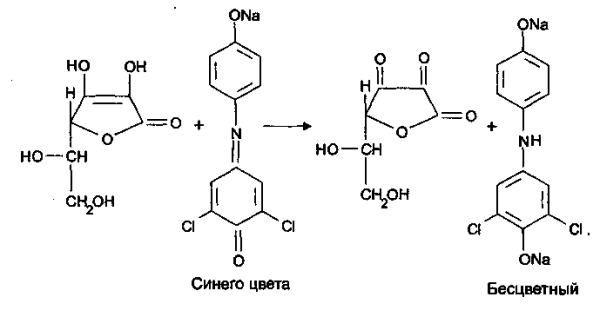
Нефармакопейные реакции:
Аскорбиновая кислота обладает восстановительными свойствами (за счет наличия в структуре молекулы двух енольных гидроксилов). Поэтому препарат вступает в ОВР с окислителями, в том числе с реактивом Фелинга, раствором йода и калием йодатом, которые окисляют кислоту до дикетоаскорбиновой.
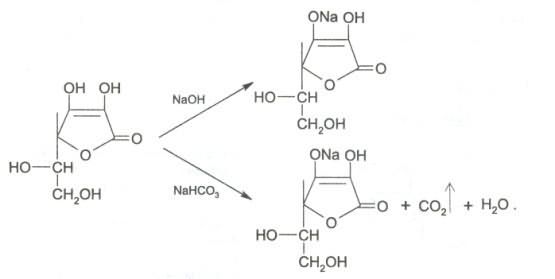
7. За счет наличия енольных гидроксилов в молекуле аскорбиновой кислоты препарат дает кислую реакцию среды на лакмус. При действии разбавленными растворами щелочей она ведет себя как одноосновная кислота. Разрыва лактонного цикла в этих условиях не происходит, а образуются нейтральные монощелочные соли.
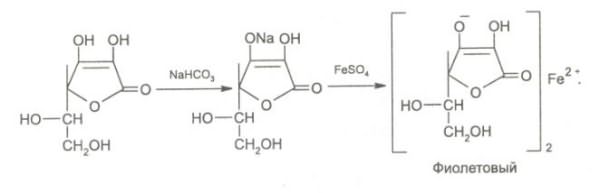
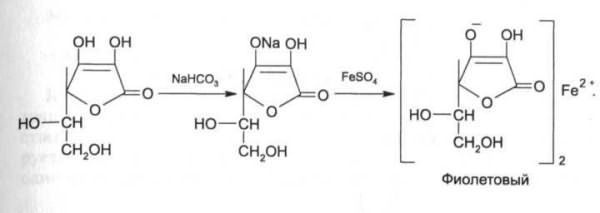
8. Кислотные свойства обуславливают реакцию образования аскорбината железа. Реактив – железа (II) сульфат, не обладающий свойствами окислителя. Происходит реакция солеобразования, наблюдается фиолетовое окрашивание.
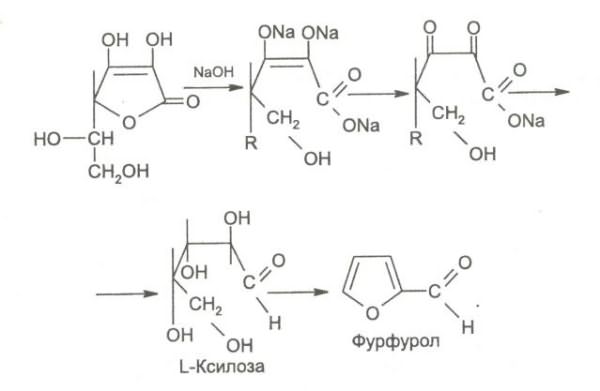
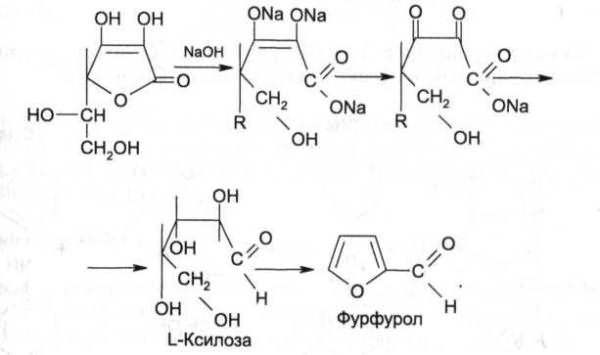
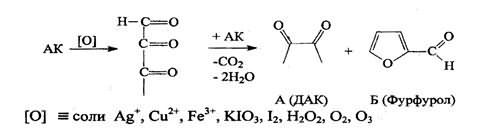
9. Взаимодействие с сильными щелочами. Происходит реакция гидролиза лактонного кольца и образование фурфурола.
По ГФХ препарат должен выдерживать испытание на органические примеси, сульфатную золу и тяжелые металлы.
Количественное определение: Йодатометрия (ГФ Х. Вариант прямого титрования)
Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и крахмала 0,1 н. стандартным раствором калия йодата до синего окрашивания:
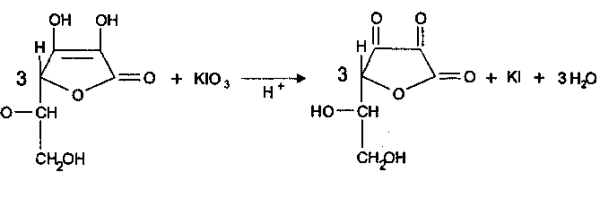
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
![]()
Возможные методы количественного определения аскорбиновой кислоты:
ОВР: йодометрия, индофенольный метод, йодхлорметрия, цериметрия. Кислотно-основные: алкалиметрия. Физико-химические: спектрофотометрия
Анализ смеси: Rp: Acidi ascorbinici 0,1
Acidi nicotinici 0,05
Sacchari 0,25
Реакция подлинности на кислоту никотиновую (ГФХ) 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС). 2. УФ-спектр 3. Тпл.=234-238°C 4. Реакция разложения кислоты никотиновой путем нагревания с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху:

5. Кислота никотиновая ввиду кислых свойств ее растворов обладает способностью образовывать нерастворимые соли (с ионами меди образуется осадок синего цвета – никотинат меди)

Если эту реакцию проводить в присутствии роданида аммония, то образуется тройное комплексное соединение, окрашенное в зеленый цвет. Если два ингредиента смеси обладают кислотными свойствами, а один из них является восстановителем, возможно их количественное определение в одной навеске. Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида. При этом значение величины z при расчете молряной массы эквиваленты М (1\z) для каждого вещества равно 1. Таким образом, Мэкв. (к-ты аскорбиновой)=176,13 г/моль, Мэкв.(к-ты никотиновой)=123,11 г/моль.
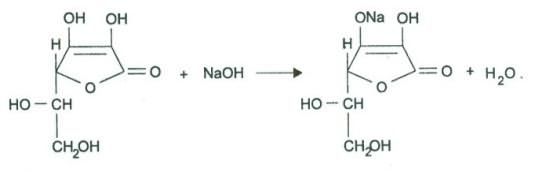
 + NaOH
+ NaOH  + H2O
+ H2O
Метод – прямая алкалиметрия, вариант нейтрализации, основан на кислотных свойствах препаратов. Титрант – 0,1 Н NaOH
Индикатор – фенолфталеин. Затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую.
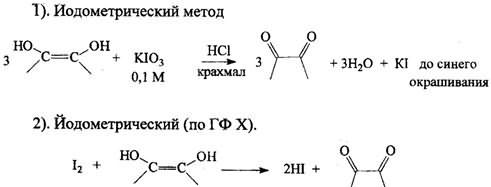
Метод – прямая йодометрия, основана на окислительно-восстановительных свойствах препарата. Титрант – 0,1 н раствор йода. Индикатор – крахмал. В точке эквивалентности наблюдается окрашивание раствора за счет взаимодействия избыточной капли йода с крахмалом и образования комплекса синего цвета.
2С+1 – 2е =2С+2 (f=1/2)
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 Н раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 Н раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой. При титровании кислоты аскорбиновой 0,1 Н раствором йода f=1/2. Мэкв.=88,06 г/моль. Это означает, что на одну и ту же аликвотную долю смеси будет расходоваться 0,1 н раствора йода в два раза больше, чем 0,1 н раствора натрия гидроксида. Поэтому при расчете количества раствора, пошедшего на титрование кислоты никотиновой, из общего объема 0,1 н раствора гидроксида натрия следует вычесть ½ объема 0,1 н раствора йода, ихрасходованного на титрование кислоты аскорбиновой.
![]()
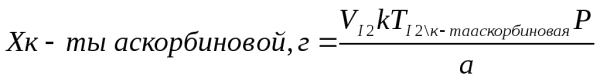
где Х – масса определяемого вещества, г; V - объем титрованного раствора, мл; k – коэффициент поправки на титрованный раствор; P – общая масса порошка по прописи, г;
а – объем, мг, или масса, г, лекарственной формы, отобранный для анализа, k - поправочный коэффициент.
1 мл 0,1 н раствора йода соответствует 0,008806 г кислоты аскорбиновой.
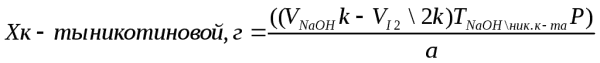
1 мл 0,1 н раствора едкого натра соответствует 0,01231 г к-ты никотиновой.
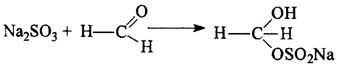
В растворах аскорбиновая кислота легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (натрия сульфит, натрия метабисульфит). В раствор аскорбиновой кислоты для инъекций добавляют натрия гидрокарбонат для нейтрализации кислой реакции среды, раздражающей ткани. При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты. Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.
StudFiles.ru
/ ДЛЯ ГОСОВ / Ответы для комиссии на экз билеты / Билет 21 Аскорбиновая к-та
1
ГОУВПО ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Медицинский институт
Специальность «Фармация»
Итоговый междисциплинарный экзамен
Экзаменационный билет №21
Задача 64
1. Комплекс испытаний, применяемых для оценки качества кислоты аскорбиновой в виде 5% раствора для инъекций, а также лекарственных форм внутриаптечного изготовления предусматривает применение в качестве реагентов соединений йода (растворы йода и калия йодата). В соответствии с химической структурой лекарственного средства дайте обоснование выбору и использованию данных реагентов в аналитическом контроле кислоты аскорбиновой:
-
Исходя их химического строения и свойств кислоты аскорбиновой, объясните способность ее реагировать с раствором йода и калия йодата.
-
Предложите другие реакции для идентификации лекарственного препарата и укажите степень их специфичности.
-
Рассмотрите применение 0,1М раствора йода в количественном определении кислоты аскорбиновой на примере лекарственной прописи состава:
Кислоты аскорбиновой 0,1
Глюкоза 0,3
-
Предложите способ количественного определения кислоты никотиновой с учетом присутствия в смеси второго компонента.
-
Укажите значение молярной массы эквивалента для обоих веществ и формулы для расчета их содержания.
-
Объясните сущность йодатометрического титрования кислоты аскорбиновой в растворе для инъекций и необходимость применения при этом раствора формальдегида. Как отразится на результате анализа его отсутствие? Укажите значение молярной массы эквивалента.
2. Охарактеризуйте стабильность кислоты аскорбиновой в водном растворе.
-
Назовите вещества, входящие в состав инъекционного раствора и обоснуйте их роль.
2. КИСЛОТА АСКОРБИНОВАЯ
Кислота аскорбиновая, имеет генетическое родство с моносахаридами, что проявляется в сходстве структурных фрагментов молекул.. Суточная потребность человека в кислоте аскорбиновой выше, чем в других витаминах, и составляет примерно 30 мг.
Физические свойства
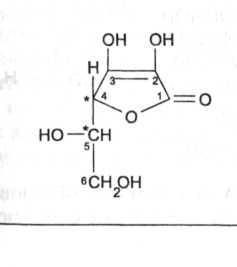
Кислота аскорбиновая - Acidumascorbinicum
Y-Лактон-2,3-дегидро-L-гулоновой кислоты.
Белый кристаллический порошок без запаха, кислого вкуса. Легко растворим в воде.Лекарственные формы: порошок, таблетки, драже, раствор для инъекций. Витаминное средство
ГФ требует определить угол вращения (а) 2% раствора и рассчитать удельное вращение по формуле:
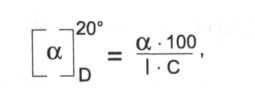
где С — концентрация раствора;
1 — длина трубки поляриметра = 1 дм.
Из-за нестойкости препарата при нагревании для определения Т^ его предварительно сушат при температуре 60 °С в течение 2 ч. Скорость подъёма температуры — 5° в 1 мин (по той же причине).
Препарат поглощает свет в УФ-области спектра, что также используется при анализе подлинности.
Химические свойства и анализ подлинности
Кислотные свойства. Аскорбиновая кислота является Y-лактоном, содержащим 2 спиртовых гидроксила в 5-м и 6-м положениях и 2 енольных гидроксила во 2-м и 3-м положении. Енольные гидроксилы обладают кислотными свойствами, дают кислую реакцию на лакмус, взаимодействуют и с NaOHи NaHCO3. Кислотные свойства более выражены у гидроксила в 3-м положении:
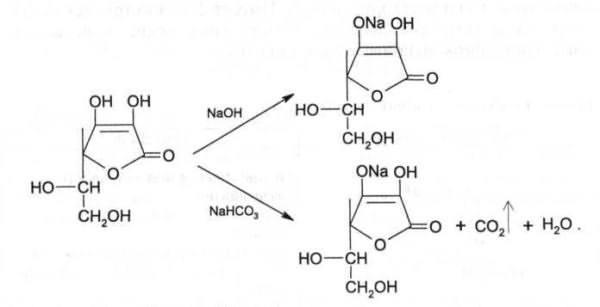
На наличии кислотных свойств основана реакция образования аскорбината железа. Реактив - железа (II) сульфат, не обладающий свойствами окислителя:
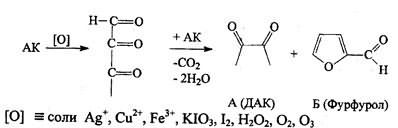
Следует иметь в виду, что аскорбиновая кислота является лакто-ном и при действии сильных щелочей лактонное кольцо гидроли-зуется, а затем образуется фурфурол:
FeCl3, реактив Фелинга и др.) окисляют кислоту аскорбиновую до кислоты дикетоаскорбиновой.
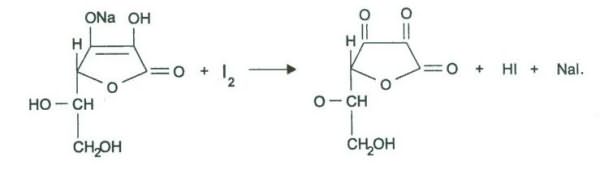
Для определения подлинности препарата обычно используют в качестве окислителей растворы 2,6-дихлорфенолиндофенолята натрия и серебра нитрата. При взаимодействии кислоты аскорбиновой с амиачным раствором серебра нитрата выпадает темный осадок металлического серебра:
Синее окрашивание 2,6-дихлорфенолиндофенолята натрия исчезает от действия на реактив кислотой аскорбиновой:
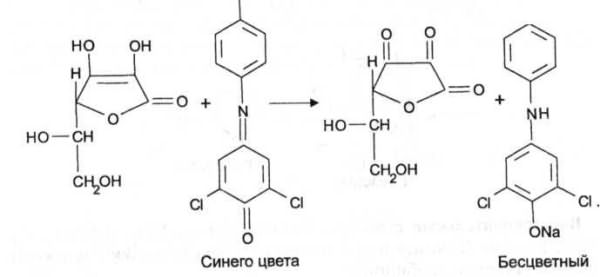
ONa
При действии сильных окислителей образуется фурфурол (см. выше).Методы количественного определения Алкалиметрия
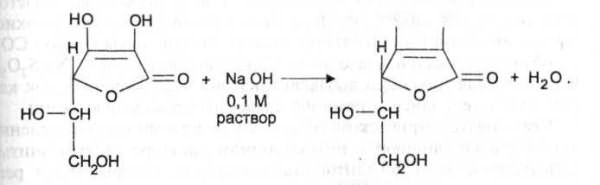
ONaОН
Кислотные свойства кислоты аскорбиновой выражены в достаточной степени, что позволяет количественно определять лекарственное вещество алкалиметрически. Кислота аскорбиновая титруется стандартным 0,1 М раствором натрия гидроксида как одноосновная кислота поВыраженные восстановительные свойства кислоты аскорбиновой лежат в основе нескольких методик количественного определения данного лекарственного вещества (йодатометрия, йодомет-рия, йодхлорметрия).
Йодатометрия
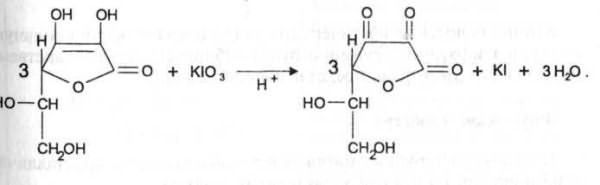
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования: кю3+ 5 KI+ 6 HCl=зI2+ 6KCl+ з н2о.
Йодометрия
Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой. кю3+ 5 KI+ 6 HCl=зI2+ 6KCl+ з н2о.
Йодометрия
Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой
Возможны и другие методики, например титрование натрия 2,6-хлорфенолиндофенолятом.ислота аскорбиновая используется в виде порошков, таблеток и растворов для инъекций. Поскольку в растворах она легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (Na2SO3, Na2S2O5). В раствор для инъекций добавляют натрия гидрокарбонат, так как препарат имеет кислую реакцию среды, раздражающую ткани.
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом - КЮ3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты:

Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.
Лекарственная форма
Кислоты аскорбиновой 0,1 Глюкозы 0,3
2.1. Установить подлинность лекарственных препаратов, содер жащихся в лекарственной форме. 2.1.А. Кислота аскорбиновая.
Обнаруживают, как указано в 1.1.А и 1.1.Б.
2.1.Б. Глюкоза. Для обнаружения глюкозы предварительно окисляют аскорбиновую кислоту (как более сильный по сравнению с глюкозой восстановитель). С этой целью 0,05—0,1 г лекарственной формы растворяют в 1—2 мл воды, прибавляют 2—3 капли пергидроля, 2—3 капли аммиака и кипятят в течение 3 мин. После охлаждения добавляют реактив Фелинга и снова нагревают. Образуется кирпично-красный осадок.
2.2. Выполнить количественное определение. 2.2.А. Кислота аскорбиновая. Растворяют 0,1 г лекарственной формы в 5 мл воды в колбе с притертой пробкой и титруют 0,1 н. раствором иода до слабо-желтого окрашивания.
1 мл 0,1 н. раствора иода соответствует 0,0088 г кислоты аскорбиновой.
2.2.Б. Глюкоза. К оттитрованной (см. 2.2.А) жидкости прибавляют 20 мл 0,1 н. раствора иода, 10—15 мл 1%-ного раствора гидроксида натрия и оставляют на 10—15 мин. Затем к раствору добавляют 10 мл разведенной серной кислоты и титруют 0,1 н. раствором тиосульфата натрия в присутствии крахмала.
1 мл 0,1 н. раствора иода соответствует 0,0099 г глюкозы.
Содержание глюкозы (х) в ЛФ рассчитывают по формуле
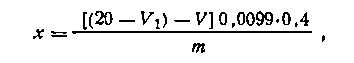
где 20 мл — объем 0,1 н. раствора иода, взятый на титрование глюкозы; Vi— объем 0,1 н. раствора тиосульфата натрия, пошедший на титрование избытка 0,1 н. раствора иода; V—объем 0,1 н, раствора иода, затраченный на дальнейшее окисление дегидроаскорбиновой кислоты (такой же, как и в первом титровании);
, %.0,0099 — титр по глюкозе; 0,4 г — общая масса лекарственной формы; т — навеска, взятая на титрование, г.
2.3. Выполнить титриметрическое и рефрактометрическое определение кислоты аскорбиновой и глюкозы в лекарственной форме. 2.З.А. Кислота аскорбиновая. Для титриметрического определения кислоты аскорбиновой массу одного порошка растворяют в 5 мл воды; 2 мл полученного раствора титруют 0,1 н. раствором гидроксида натрия или иода (титр 0,1 н. раствора гидроксида натрия по аскорбиновой кислоте — 0,0176 г, а титр 0,1 н. раствора иода — 0,0088 г). Содержание кислоты аскорбиновой {х\) в 5 мл рассчи тывают по формуле
![]()
![]()
где пх— показатель преломления раствора лекарственной формы; п0 — показатель преломления растворителя; т — масса лекарственной формы, г; 0,00142 — фактор показателя преломления безводной глюкозы; Х\ — содержание аскорбиновой кислоты, г; F— фактор показателя преломления кислоты аскорбиновой, соответствующий найденной концентрации; В — содержание влаги в глюкозе
Bp: Acidi ascorbinici 0,1 Glucosi0,3
M.f.p. D.td. M30 S. ПоI nop. З раза в день
Качественный анализ.
Кислота аскорбиновая. 0,01 лекарственной формы растворить в 2 мл воды, прибавить 2 капли раствора серебра нитрата. Отметить эффект реакции.
Глюкоза (в присутствии кислоты аскорбиновой).
0,05 лекарственной формы растворить в 2 мл воды, прибавить по 2 капли пергидроля и раствора аммиака и прокипятить. После охлаждения добавить реактив Фелинга и снова нагреть. Отметить эффект реакции.
Количественный анализ {первый вариант).
Кислота аскорбиновая,
0,25 лекарственной формы растворить в мерном цилиндре в 5 мл воды очищенной, перемешать. К 2 мл раствора прибавить 2 капли фенолфталеина и титровать раствором щелочи с Сэ 0,1 моль/л
Количественный анализ (второй вариант).
Кислота аскорбиновая, О O5 лекарственной формы растворить в 5 мп воды в слянке с притертой пробкой и титровать раствором йода с Сэ 0,1 моль/л до слабо-желтого окрашивания. Пошло
1,41,1,40,1,45=4.26/3 Сумма = 1.42 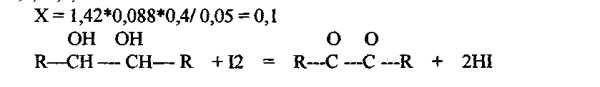

Глюкоза (в присутствии кислоты аскорбиновой).
К оттитрованной жидкости прибавить 10 мл раствора йода с Сэ 0,1 моль/л, 5 мл 1% раствора щелочи и оставить на 15 минут. Далее к раствору прибавить 5 мл разведенной серной кислоты и выделившийся йод оттитровать раствором тиосульфата натрия с Сэ О,1 моль/л. Индикатор - крахмал.На титрование пошло (4,80,4,75,4,84 =14,39 /3 = 4,79) Содержание глюкозы рассчитать по формуле:
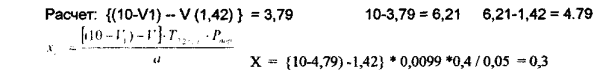
где v 1 - ооъем тиосульфата натрия пошедшего на титрование изоыточного количества йода; V - объем йода пошедшего на титрование навески кислоты аскорбиновой; а -навеска порошка, взятая для количественного анализа.
М.м глюкозы = 198,17 г/моль
1
StudFiles.ru
Ситуационная задача №
Фармацевтическое предприятие производит таблетки аскорбиновой кислоты 0,1г с глюкозой в контурно-ячеечной упаковки 370. Для определения лекарственных веществ в составе таблеток предложите достоверные реакции идентификации и их количественного определения при их совместном присутствии.
•Приведите химические формулы кислоты аскорбиновой и глюкозы. Охарактеризуйте строение и физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
•Дайте сравнительную оценку химических свойств данных лекарственных веществ и предложите реакции идентификации и методы количественного определения при их совместном присутствии. Напишите уравнения реакций
Acidum ascorbinicum
Кислота аскорбиновая
Vitaminum C
Витамин С
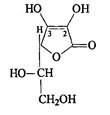
g-лактон 2,3-дегидро-α-гулоновой кислоты
Фармакологическая группа: витаминное средство.
Медицинское применение: для профилактики и лечения цинги, при геморрагических диатезах, носовых, легочных, печеночных, маточных и др. кровотечениях.
Glucosum
Глюкоза

Фармакологическая группа: препарат разных фармакологических групп.
Медицинское применение: изотонический раствор применяют для пополнения организма жидкостью, вместе с тем он является источником ценного питательного материала. Применяется при различных заболеваниях.
2.
Кислота аскорбиновая относится к группе производных ненасыщенных полиокси-γ-лактонов. По химическому строению кислота аскорбиновая представляет γ-лактон-2,3-дегидро-L-гулоновой кислоты.
Ввиду наличия в молекуле двойной связи возможно существование геометрических цис- и транс-изомеров кислоты аскорбиновой. Однако, пока известен только один из них цис-изомер. Два асимметрических атома углерода обуславливают существование четырех оптических изомеров. Все они получены синтетическим путем только L-изомер является физиологически активным.
Глюкоза.
Углевод, представляет собой полиоксикарбонильное соединение, глюкоза является полиоксиальдегидом. Глюкоза - моносахарид. Может существовать в открытой (в ациклической и циклической) форме. Карбонильная группа взаимодействует с одной из гидроксильных групп, образуя циклический полуацеталь.
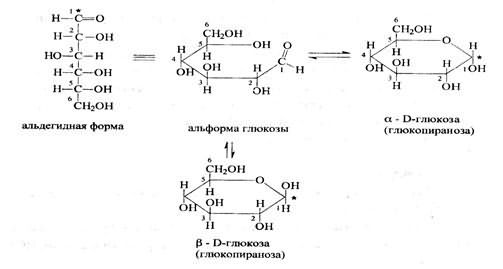
3.
Аскорбиновая кислота.
Описание: белый кристаллический порошок, без запаха, кислого вкуса.
Растворимость: легко растворима в воде, растворима в спирте, практически нерастворима в эфире, бензоле и хлороформе.
Удельное вращение: от + 22° до + 24°. (2% водный раствор)
Температура плавления: 190-193°С (с разложением).
Кислоту аскорбиновую идентифицируют по температуре плавления, удельному вращению, которое обусловлено наличием двух асимметрических атомов углерода (указано выше).
Глюкоза.
Описание: бесцветные кристаллы или белый мелкокристаллический порошок, без запаха, сладкого вкуса.
Растворимость: растворима в 1,5 ч воды, трудно растворима в 95% спирте, практически нерастворима в эфире.
Удельное вращение: от +51,5° до +53°(10% водный раствор). Препарат предварительно сушат при 100-105 °С до постоянного веса. Измерение угла вращения производят после прибавления к раствору препарата 2 капель раствора аммиака.
Потеря в весе при высушивании (за счет кристаллизационной воды) не должна превышать 10%.
Для оценки качества используют оптические свойства глюкозы (удельное вращение). При определении удельного вращения глюкозы необходимо добавление нескольких капель раствора аммиака. При добавлении катализаторов (NH3), а также неорганических и органических кислот увеличивается скорость мутаротации.
Явление мутаротации заключается в следующем:
В свежеприготовленных растворах происходит установление таутомерного равновесия ациклической альдозы с их изомерами, находящимися в пиранозной и фуранозной формах - явление мутаротации.
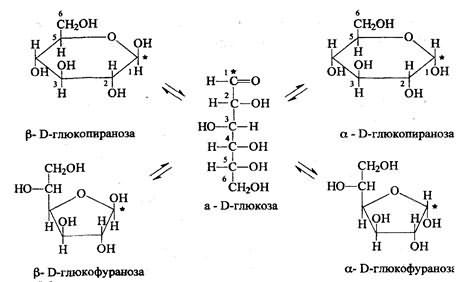
Мутаротация выражается в изменении оптического вращения свежеприготовленных растворов моносахаридов до достижения равновесного значения.
Причина - различие конфигурации ассиметричного углеродного атома, возникающего при циклизации Д-глюкозы. Если проводить определение угла вращения глюкозы сразу после ее растворения и без прибавления к этому раствору аммиака, то величина угла вращения будет равна + 109,16 град и конечного значения + 52,3 град достигнет только через несколько часов.
4.
Химические свойства глюкозы.
Глюкоза- моносахарид. И для нее характерны реакции типичные для альдегидов и для многоатомных спиртов.
1). Как карбонильное соединение вступает в реакции
конденсации по альдегидной группе (например, с фенилгидразином, НСL, тиолами).
2). Как полиоксифенильное соединение вступает в реакции ацилирования, алкилирования, конденсации с альдегидами.
3). Полуацетальный гидроксил обуславливает восстановительные свойства:
-с реактивом Фелинга, Cu2+ → Cu2O
-с [Ag(NH3)2]+→ Ag0
4). Моносахариды гидролизуются до фурфурола и его производных.
5). Оптические свойства моносахаридов определяют характерные константы для препаратов.
Реакции подлинности.
1). Подлинность глюкозы устанавливают, нагревая до кипения растворы препаратов с реактивом Фелинга (красный осадок)
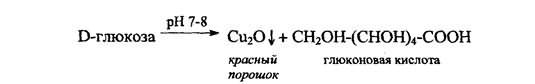
2). Путем взаимодействия глюкозы с аммиачным раствором AgNO3.. При этом выделяется черный осадок Ag0. В присутствии [Ag(NH3)2]+
Д-глюкоза→СН2OH-(CHOH)4-COOH + Ag0
3). Образованием комплексного соединения при взаимодействии
нитрата кобальта Co(NO3)2 и NaOH. При этом появляется фиолетовое окрашивание.
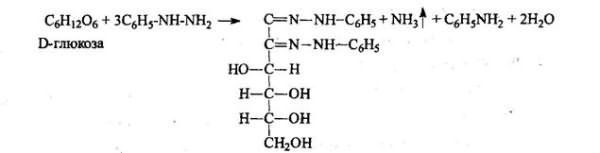
4). Взаимодействием глюкозы с фенилгидразином с образованием кристаллических фенилгидразонов, последующим нагревом на водяной бане и образованием озазонов. Озазоны имеют характерные Тпл.
5). Преобразованием глюкозы в оксиметилфурфурол. Реакция основана на получении фурфурола из глюкозы при действии концентрированной серной или соляной кислоты с одновременным взаимодействием фурфурола с каким-либо фенолом или ароматическим амином (резорцином, тимолом, ∆-нафтолом, Е-нафтолом, морфином, фенацетином, нафтиламином и др.)
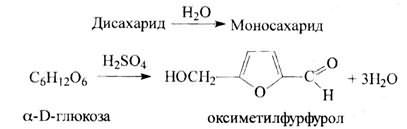
Для фурфурола типичной является реакция получения полиметиновых производных:

6). Взаимодействием моносахаридов с раствором антрона в концентрированной серной кислоте:

При этом появляется зеленое окрашивание, переходящее в синезеленое.
7). Цветная реакция с 0,5%-ным раствором хлорида трифенилтетразола в присутствии раствора гидроксида натрия с выпадением красного осадка трифенилформазона:
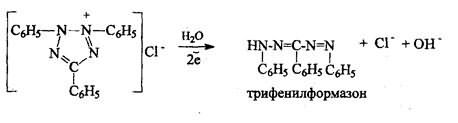
Химические свойства аскорбиновой кислоты.
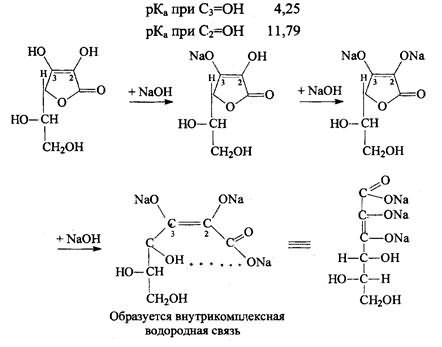
1). Кислотно-основные свойства. Обусловлены ендиольной группировкой аскорбиновой кислоты, а именно подвижностью атомов водорода. При нитровании АК ведет себя как одноосновная кислота, но в сильнощелочных средах она способна образовывать 3-х основную соль.
Обычно протекает только 1 стадия. Действие карбонатов и гидрокарбонатов (СО и НСО аналогично.
2). Окисление. Подвижность водородных атомов сказывается и на окислении вит. С. Отдавая водород, он превращается в дегидроаскорбиновую кислоту (ДАК). Е = 0,33 В.

Благодаря обратимости этого процесса аскорбиновая кислота (АК) являет я переносчиком водорода в ферментных системах. При длительном воздействии окислителей образуется 2,3-дикето--L гулоновая кислота.
Образование сложных эфиров с высокомолекулярными жирными кислотами при С5 и С6- атомах. Эфиры физиологическим действием не обладают.
Подлинность.
1. Реакция окисления аскорбиновой кислоты. Основана на свойстве АК как сильного восстановителя окисляться до ДАХ, реагент при этом восстанавливается.
а). Реакция серебряного зеркала.
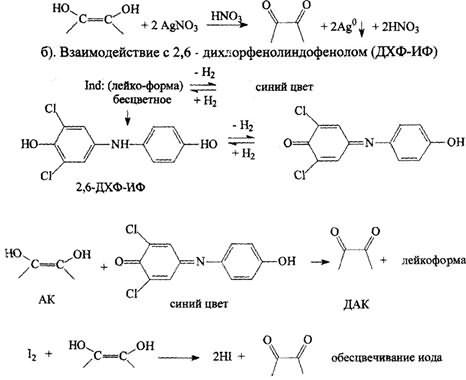
в). Титрование иодом.
г). Реакция с К3Fe(СN)6 и FeCl3 синее окрашивание – берлинская лазурь
д). Реакция с раствором Фелинга.
2). Реакции, основанные на кислотно-основных свойствах аскорбиновой кислоты.


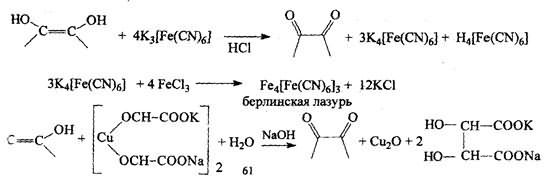
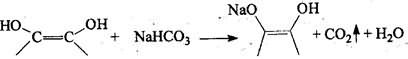
З). На основе физических и физико-химических методов:
температура плавления Т = 190-192° С; удельное вращение [α]20D= + 23°
Количественное определение глюкозы.
Количественное определение препаратов глюкозы НТД не предусмотрено.
1). Содержание глюкозы определяют йодометрическим методом, основанном на окислении альдегидной группы щелочными растворами иода до образования натриевой соли глюконовой кислоты.
CH2OH(CHOH)4COOH + I2 +3NaOH → CH2OH(CHOH)4COONa + 2NaI + 2H2O
2). С использованием раствора Фелинга. К навеске препарата добавляют точно отмеренное количество раствора, а затем йодометрически устанавливают остаток неизрасходованного на окисление катиона меди (II). По разности вычисляют, сколько получилось восстановленной меди и, соответственно, содержание глюкозы .
3). Поляриметрическим методом определения сахаров, основанным на измерении угла вращения поляризованного луча. Угол вращения ∆ (в градусах), измеряемый на поляриметре, и удельное вращение [∆]20D связаны между собой уравнением:
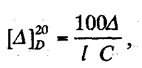
где 1- длина трубки, дм, С - объемная доля, %,∆ - угол вращения
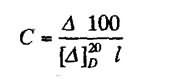
Количественное определение аскорбиновой кислоты.
Количественное определение, основанное на окислительно-восстановительных свойствах аскорбиновой кислоты.
индикатор - крахмал, до появления устойчивого синего окрашивания или без индикатора - до устойчивой желтой окраски.
З). Индофенольный - для определения АК в плодах шиповника (ГФ ХI, МФ). Титруют 2,6 - дихлорфенолиндофенолятом натрия в кислой среде
- образуется бесцветное лейко-основание, титруют до розового окрашивания (избыточная капля титранта в кислой среде).
4). Ферриметрический
Титрант: Fe2(SO4)4 или FeCL3
Среда – Н2SO4 или НСI, соответственно, для подавления гидролиза солей железа.

Титрование ведут после нагревания, индикатор - роданид аммония
В точке эквивалентности:
3(NH4)SCN + Fe3+→ Fe(SCN)3 +3 NH4+
красное окрашивание
Метод селективного определения аскорбиновой кислоты в присутствии других восстановителей, например, белков, сахаров, фенольных производных, цистевяа.
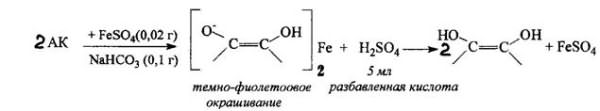
Основанное на реакции кислотного типа. Темно-фиолетовое окрашивание
Алкалиметрический метод нейтрализации - прямое титрование с индикатором - фенолфталеином до розовой окраски.
Используется в многокомпонентной лекарственной форме.
Физико-химические методы
1). Фотоколориметрический, с использованием цветных реакций с
2,б-дихлорфенолиндофенолом, фосфорномолибденовой кислотой - цветные реакции.
2). Спектрофотоколориметрический, исследуют УФ-область:
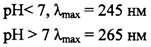
для определения аскорбиновой кислоты Na2S2O3 связывают добавлением формальдегида
Определение глюкозы в данной лекарственной форме по удельному вращению затруднительно, т.к. аскорбиновая кислота тоже является оптически активной. Определение глюкозы в данной лек.форме проводят рефрактометрически. Определяют коэффициент преломления воды(n0) и показатель преломления приготовленного раствора (n)
Mглюк.= [ (n-n0)- Cаск.к-ты * Fаск.к-ты] *5*0,5/ 0,00142*100*0,05
Где F- фактор показателя преломления аскорбиновой кислоты, 0,00142- фактор показателя преломления безводной глюкозы.
5.
Аскорбиновая кислота хранится в хорошо укупоренной таре, предохраняющей от действия света и кислорода воздуха (т.к. аскорбиновая кислота окисляется). Устойчива в кристаллической форме (в отсутствие влаги), она в растворах быстро окисляется.
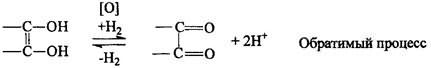
При длительном воздействии окислителей образуется 2,3-дикето-Lгулоновая кислота.
Глюкоза.
Хранится в хорошо укупоренной таре при комнатной температуре. Глюкоза в водных растворах при хранении окисляется.
Д-глюкоза  CH2OH-(CHOH)4-COOH
CH2OH-(CHOH)4-COOH
Глюконовая кислота
Растворы для инъекций необходимо стерилизовать. При стерилизации растворов глюкозы для инъекций происходит окисление, полимеризация и карамелизация глюкозы. При этом наблюдается потемнение, а иногда и побурение растворов. Необходимо добавлять стабилизаторы. Применяют соляную кислоту и хлорид натрия, т.к. при рН=3-4 реакция разложения замедляется. Соляная кислота нейтрализует щелочность стекла. Хлорид натрия смещает равновесие в сторону образования циклической формы глюкозы, которая более устойчивая. Также хлорид натрия образует комплексное соединение по месту альдегидной группы и тем самым предупреждает окислительно-восстановительный процесс.
Применяют два стабилизатора:
1. фармакопейный
NaCl 0,26
0,1M HCl 5 ml
На 1 л раствора глюкозы.
2. аптечный
NaCl 5,2
HCl разб. (8,3%) – 4,4 ml
Воды для инъекций до 1000 ml
Такого стабилизатора берут 5% от объема раствора глюкозы независимо от концентрации.
studopedia.ru
Задача 120
5.Дайте характеристику лекарственному растительному сырью «Шиповника плоды».
Приведите латинские названия сырья, производящего растения, семейства.
• Укажите химический состав. Объясните, с учетом физико-химических свойств, какими методами подтверждают наличие и определяют количество действующих веществ в сырье?
•
• Сырье, содержащее аскорбиновую кислоту
Fructus Rosae — плоды шиповника
(Rosae fructus — шиповника плод)
Собранные в период полного созревания и высушенные плоды дикорастущих и культивируемых кустарников различных видов шиповника (розы) Rosa L. из сем. розоцветных (Rosaceae); используют в качестве лекарственного средства и лекарственного сырья.
В медицине используются представители:
секц. Rugosae Chrshan.: шиповник морщинистый (Rosa rugosa Thunb.);
секц. Cinnamomeae DC: шиповник майский (ш. коричный) — Rosa majalis Herrm. (R. cinnamomea L), ш. иглистый (R. acicularis Lindl.), ш. даурский (R. davurica Pall.), ш. Беггера (R. beggeriana Schrenk), ш. Федченко (R. fedtschenkoana Regel), ш. кокандский (R. kokanica (Regel) Regel ex Juz.);
• секц. Caninae DC: ш. собачий (R. canina L.), ш. щитконосный (R. corymbifera Borkh.), ш. мелкоцветковый (R. micrantha Borrer ex Smith), ш. песколюбивый (R. psammophila Chrshan.), ш.войлочный (R. tomentosa Smith), ш. зангезурский (R. zangezura P. Jarocs) и некоторые другие виды
Химический состав.Плоды шиповника содержат кислоту аскорбиновую (от 0,2-1 % у низковитаминных видов и до 4-5 % у высоковитаминных), каротиноиды (р-каротин и др.) до 10 мг%, токоферолы (витамин Е), флавоноиды (флавонолы — рутин, кемпферол; катехины; лейкоантоцианидины; антоцианы), гидролизуемые и конденсированные дубильные вещества, органические кислоты — лимонная и яблочная (2-4 %), жирное масло, пектиновые вещества (до 14%), сахара (до 24 %), около 0,9 % свободных аминокислот (в основном аспарагиновой).
Качественное определение витамина С:
Реакция с раствором серебра нитрата. Берут 2 мл извлечения и приливают 0,5 мл раствора серебра нитрата. При наличии аскорбиновой кислоты образуется темный осадок.
Реакция с раствором 2,6-дихлорфенолиндофенола. Берут несколько капель извлечения, разбавленного водой в соотношении 1:1000, и по каплям прибавляют раствор 2,6-дихлорфенолиндофенола. Синяя окраска реактива будет исчезать
Хроматографическое обнаружение аскорбиновой кислоты в плодах шиповника. Измельчают в ступке около 0,5 г плодов шиповника, добавляют
5 мл воды очищенной, перемешивают, оставляют на 15 минут и профильтровают. Полученное извлечение наносят на хроматографическую пластинку «Силуфол» и рядом – достоверный образец аскорбиновой кислоты. Пластинку помещают в хроматографическую камеру с системой растворителей: этилацетат – ледяная уксусная кислота (8:2). Хроматограмму, после прохождения фронта растворителя, примерно 15 см (20-30 мин), высушивают на воздухе. Пластинку обрабатывают из пульверизатора 0,04% (или 0,001 моль/л) водным раствором 2,6-дихлорфенолиндофенолятом натрия. Аскорбиновая кислота обнаруживается в виде белого пятна на розовом фоне.
Хроматографическое обнаружение каротиноидов в плодах рябины обыкновенной. Измельчают в ступке около 1,0 г плодов рябины обыкновенной, помещают в колбу, емкостью 25 мл, залейте 5 мл хлороформа и оставляют на 1,5 часа при периодическом встряхивании. Фильтрат наносят капилляром на хроматографическую пластинку «Силуфол» и рядом – достоверный образец β-каротина. Пластинку помещают в хроматографическую камеру с системой растворителей: циклогексан – диэтиловый эфир («8:2). Хроматограмму, после прохождения фронта растворителя, примерно 15 см (20-30 мин), высушивают на воздухе. Пластинку обрабатывают из пульверизатора 10% раствором фосфорномолибденовой кислоты в этаноле и прогревают в сушильном шкафу при температуре 60-80°С. Каротиноиды обнаруживаются в виде пятен синего цвета на желто-зеленом фоне.
Количественное определение аскорбиновой кислоты
в плодах шиповника:
Из грубо измельченной аналитической пробы плодов берут навеску массой 20,0 г, помещают в фарфоровую ступку, где тщательно растирают со стеклянным порошком (около 5 г), постепенно добавляя 300 мл воды очищенной, настаивают 10 мин. Далее смесь размешивают и извлечение отфильтровают. В коническую колбу вместимостью 100 мл внести 1 мл полученного фильтрата, 1 мл 2% раствора хлористоводородной кислоты, 13 мл воды, перемешивают и оттитровывают из микробюретки раствором 2,6-дихлор-фенолиндофенолята натрия (0,001 моль/л), до появления розовой окраски, не исчезающей в течение 30-60 с. Титрование продолжают не более 2 мин. В случае интенсивного окрашивания фильтрата или высокого содержания в нем аскорбиновой кислоты (расход раствора
2,6-дихлорфенолиндо-фенолята натрия (0,001 моль/л) более 2 мл), обнаруженного пробным титрованием, исходное извлечение разбавляют водой в
2 раза или более.
Содержание аскорбиновой кислоты в пересчете на абсолютно сухое сырье в процентах вычисляют по формуле:
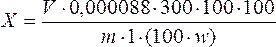 ,
,
где V – объем раствора 2,6-дихлорфенолиндофенолята натрия (0,001 моль/л), пошедшего на титрование, мл;
m – масса сырья, г;
w – потеря в массе при высушивании сырья, %;
300 – объем извлечения, соответствующий всей навеске; 1 – объем извлечения, взятого на титрование.
1 – объем извлечения, взятого на титрование.
• Задача 121
• 4. Дайте характеристику лекарственному растительному сырью -«Василька синего цветки». Приведите латинские названия сырья, производящего растения, семейства.
• • Укажите химический состав. Объясните, с учетом физико-химических свойств, какими методами подтверждают наличие и определяют количество действующих веществ в сырье?
Flores Centaureae cyani — цветки василька синего
(Centaureae cyani flos — василька синего цветок)
Собранные в период цветения и высушенные краевые и срединные цветки одно- и двулетнего дикорастущего травянистого растения василька синего (Centaurea cyanus L) из сем. сложноцветных — Asteraceae (Compositae); используют в качестве лекарственного средства.
Химический состав.Основными действующими веществами цветков являются антоцианы: цианин — диглюкозид цианидина, гликозиды пеларгонидина, флавоноиды, представленные производными апигенина, лютеолина, кверцетина и кемпферола. Кроме того, присутствуют кумарины (цикорнин), дубильные вещества, немного эфирного масла.
studopedia.ru
Читайте также
![Кислоты определение Кислоты определение]() Кислоты определение
Кислоты определение- Актив определение
![Вопросы определения Вопросы определения]() Вопросы определения
Вопросы определения![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Дайте определение понятию авария Дайте определение понятию авария]() Дайте определение понятию авария
Дайте определение понятию авария![Гражданское право определение Гражданское право определение]() Гражданское право определение
Гражданское право определение![Генетическое определение пола кратко Генетическое определение пола кратко]() Генетическое определение пола кратко
Генетическое определение пола кратко![Генетические механизмы определения пола Генетические механизмы определения пола]() Генетические механизмы определения пола
Генетические механизмы определения пола- Выберите один из вариантов определения истины это
![Акт определение Акт определение]() Акт определение
Акт определение![Давление определение Давление определение]() Давление определение
Давление определение![Деталь определение Деталь определение]() Деталь определение
Деталь определение
 Кислоты определение
Кислоты определение Вопросы определения
Вопросы определения Болезнь определение
Болезнь определение Дайте определение понятию авария
Дайте определение понятию авария Гражданское право определение
Гражданское право определение Генетическое определение пола кратко
Генетическое определение пола кратко Генетические механизмы определения пола
Генетические механизмы определения пола Акт определение
Акт определение Давление определение
Давление определение Деталь определение
Деталь определение