Металлы
О соответствующем направлении рок-музыки см. Метал. Металлы — одни из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории.
Металлы — одни из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории.
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на данный момент, к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra
а также вне определённых групп бериллий и магний
40 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
— Ac, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))[4].
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).[5]
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[6]. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Производство металлов
Основные статьи: Руда, Добыча полезных ископаемых, Обогащение руд, Металлургия, МеталловедениеМеталлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространенные металлы, такие, как железо, плавят с использованием в качестве восстановителя углерода. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[7][8]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Свойства металлов
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:[9] Твёрдость Металл| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть(тв.) |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
N a 2 O 2 + 2 N a = 2 N a 2 O {\displaystyle {\mathsf {Na_{2}O_{2}+2Na=2Na_{2}O}}}Со средними и малоактивными металлами реакция происходит при нагревании:
3 F e + 2 O 2 = F e 3 O 4 {\displaystyle {\mathsf {3Fe+2O_{2}=Fe_{3}O_{4}}}} 2 H g + O 2 = 2 H g O {\displaystyle {\mathsf {2Hg+O_{2}=2HgO}}} 2 C u + O 2 = 2 C u O {\displaystyle {\mathsf {2Cu+O_{2}=2CuO}}}- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
2 A l + N 2 = 2 A l N {\displaystyle {\mathsf {2Al+N_{2}=2AlN}}} 3 C a + N 2 = C a 3 N 2 {\displaystyle {\mathsf {3Ca+N_{2}=Ca_{3}N_{2}}}}- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
F e + S = F e S {\displaystyle {\mathsf {Fe+S=FeS}}}- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
M g + 2 H C l = M g C l 2 + H 2 ↑ {\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}} 2 A l + 2 H 3 P O 4 = 2 A l P O 4 + 3 H 2 ↑ {\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}Взаимодействие концентрированной серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
C u + 2 H 2 S O 4 = C u S O 4 + S O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}Очень разбавленная кислота реагирует с металлом по классической схеме:
M g + H 2 S O 4 = M g S O 4 + H 2 ↑ {\displaystyle {\mathsf {Mg+H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow }}}При увеличении концентрации кислоты образуются различные продукты:
M g + 2 H 2 S O 4 = M g S O 4 + S O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Mg+2H_{2}SO_{4}=MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}} 3 M g + 4 H 2 S O 4 = 3 M g S O 4 + S ↓ + 4 H 2 O {\displaystyle {\mathsf {3Mg+4H_{2}SO_{4}=3MgSO_{4}+S\downarrow +4H_{2}O}}} 4 M g + 5 H 2 S O 4 = 4 M g S O 4 + H 2 S ↑ + 4 H 2 O {\displaystyle {\mathsf {4Mg+5H_{2}SO_{4}=4MgSO_{4}+H_{2}S\uparrow +4H_{2}O}}}Реакции для азотной кислоты (HNO3)
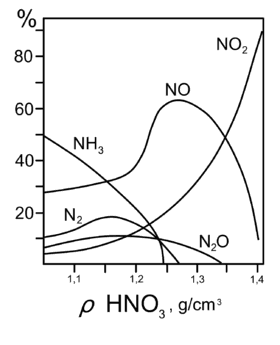 Продукты взаимодействия железа с HNO3 разной концентрации C u + 4 H N O 3 ( 60 % ) = C u ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}} 3 C u + 8 H N O 3 ( 30 % ) = 3 C u ( N O 3 ) 2 + 2 N O ↑ + 4 H 2 O {\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
Продукты взаимодействия железа с HNO3 разной концентрации C u + 4 H N O 3 ( 60 % ) = C u ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}} 3 C u + 8 H N O 3 ( 30 % ) = 3 C u ( N O 3 ) 2 + 2 N O ↑ + 4 H 2 O {\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
При взаимодействии с активными металлами вариантов реакций ещё больше:
Z n + 4 H N O 3 ( 60 % ) = Z n ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)=Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}} 3 Z n + 8 H N O 3 ( 30 % ) = 3 Z n ( N O 3 ) 2 + 2 N O ↑ + 4 H 2 O {\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)=3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}} 4 Z n + 10 H N O 3 ( 20 % ) = 4 Z n ( N O 3 ) 2 + N 2 O ↑ + 5 H 2 O {\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)=4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}} 5 Z n + 12 H N O 3 ( 10 % ) = 5 Z n ( N O 3 ) 2 + N 2 ↑ + 6 H 2 O {\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)=5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}} 4 Z n + 10 H N O 3 ( 3 % ) = 4 Z n ( N O 3 ) 2 + N H 4 N O 3 + 3 H 2 O {\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)=4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Электронное строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Некоторые группы/семейства металлов
 Осмий
Осмий  Алюминий
Алюминий  Барий
Барий
- Щелочные:
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
- Щёлочноземельные:
- Кальций
- Стронций
- Барий
- Радий
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Бериллий
- Магний
- Переходные:
- Уран
- Титан
- Железо
- Платина
- Медь
- Цинк
- Золото
- Серебро
- Палладий
- Ртуть
- Никель
- Кобальт
- Вольфрам
- Постпереходные:
- Лёгкие:
- Алюминий
- Галлий
- Свинец
- Олово
- Тяжёлые:
- Свинец
- Ртуть
- Медь
- Кадмий
- Кобальт
- Лёгкие:
- Тугоплавкие:
- Металлы платиновой группы:
- Цветные:
- Благородные:
- Монетные:
Аморфные металлы
Основная статья: Аморфные металлыПрименение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
История развития представлений о металлах
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образования всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Лишь Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
ru.wikipedia.org
металл это:
металл мета́лл сущ., м., употр. сравн. часто Морфология: (нет) чего? мета́лла, чему? мета́ллу, (вижу) что? мета́лл, чем? мета́ллом, о чём? о мета́лле; мн. что? мета́ллы, (нет) чего? мета́ллов, чему? мета́ллам, (вижу) что? мета́ллы, чем? мета́ллами, о чём? о мета́ллах 1. Металлом является простое вещество (или сплав), которое блестит, хорошо проводит тепло и электричество.Плавить металл. | Токарь по металлу. | Если грузовик подбрасывало, раздавалось звяканье металла.
2. Чёрными металлами являются железо и его сплавы.На улице висели кованые из чёрного металла узорчатые фонари.
3. Благородными, или драгоценными, металлами называют золото, серебро, платину.Ломбард предоставляет ссуды под залог изделий из драгоценных металлов. | Свинец — легкоплавкий, он — отец благородных металлов.
4. Цветными металлами называют все металлы, кроме чёрных.Он обнаружил пять тонн цветных металлов.
5. Тяжёлыми металлами называют вещества, например свинец, которые скапливаются в воде, почве и т. п. и являются вредными для здоровья.В этой воде было много хлора и солей тяжёлых металлов.
6. Тяжёлым металлом называют музыкальный стиль, в котором большую роль играют ударные и басовые инструменты (от английского heavy metal).Группа играет тяжёлый металл самой высокой пробы.
7. Презренным металлом шутливо называют деньги или изделия из золота, серебра, платины.В преддверии повышения цен на презренный металл в магазинах выстраивались огромные очереди. | Я понял, что пора объясниться. Но не по поводу презренного металла, а по поводу моих интеллектуальных доходов.
8. Металлом называют суровую, категоричную интонацию в голосе.Амалия Казимировна нахмурилась, и в голосе её зазвучал металл. | У него был низкий бас с густым металлом.
Толковый словарь русского языка Дмитриева. Д. В. Дмитриев. 2003.
.
dic.academic.ru
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
I| Группа | III | IV | V | VI | VII | VIII | |
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
химических элементов Блок периодической таблицы Другое
| Дмитрий Иванович Менделеев · Периодический закон · Группы элементов | |
| Короткая · По блокам · Расширенная · Увеличенная · Электронные конфигурации · Электроотрицательность · Альтернативная · Изотопы элементов | |
| Названию · Этимологии · Наименованиям в честь географических мест · Наименованиям в честь персон · Времени открытия Степени окисления · Распространённости (в человеке: микроэлементы, макроэлементы; · Органогены) · Стабильности изотопов · Твёрдости · Величине стандартных электрохимических потенциалов |
|
| 1 · 2 · 3 · 4 · 5 · 6 · 7 · 8 · 9 · 10 · 11 · 12 · 13 · 14 · 15 · 16 · 17 · 18 | |
| 1 · 2 · 3 · 4 · 5 · 6 · 7 · 8 | |
| Неметаллы · Полуметаллы (металлоиды) · Металлы · Непереходные элементы · Переходные металлы · Постпереходные металлы · Внутренние переходные металлы (Лантаноиды, Актиноиды, + Трансурановые) · Сверхпереходные металлы · Лёгкие металлы · Тяжёлые металлы · Сверхтяжелые элементы · Тугоплавкие металлы · Металлы платиновой группы · Благородные металлы · Монетные металлы · Цветные металлы · Радиоактивные элементы · Искусственные элементы · Редкие элементы · Редкоземельные элементы · Рассеянные элементы · Моноизотопные элементы · Полиизотопные элементы | |
| s-элементы · p-элементы · d-элементы · f-элементы · g-элементы | |
| Лантаноидное сжатие · Актиноидное сжатие (гипотеза) · Предсказанные элементы · Символы химических элементов (список) | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
ru.wikipedia.org
Запишите определения: Металлы - это ...НЕметеллы - это.. . По химии. . Жуткие с ней проблемы (((
..НЕметеллы - это... По химии. . Жуткие с ней проблемы (((
Карабас-барабас
МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные свойства металла обусловлены наличием свободно перемещающихся электронов в его кристаллической решетке. Из известных в настоящее время 107 химических элементов 85 относятся к металлам.
Деление всех химических элементов периодической системы Д. И. Менделеева на металлы и неметаллы является условным. Если в периодической таблице провести диагональ через бор и астат, то в главных подгруппах, расположенных справа от диагонали, будут неметаллы, а в главных подгруппах слева от диагонали, побочных подгруппах и в восьмой группе (кроме инертных газов) — металлы. Причем элементы рядом с разделительной линией являются так называемыми металлоидами, т. е. веществами с промежуточными свойствами (металлов и неметаллов) . К ним относятся: бор В, кремний Si, германий Gе, мышьяк Аs, сурьма Sb, теллур Те, полоний Ро.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп) . Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Неметаллы - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
$Wet!K
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Характерные свойства металлов
Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
Хорошая электропроводность
Возможность лёгкой механической обработки (см. : пластичность; однако некоторые металлы, например германий и висмут, непластичны)
Высокая плотность (обычно металлы тяжелее неметаллов)
Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
Большая теплопроводность
В реакциях чаще всего являются восстановителями
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
Кроме того, к неметаллам относят также водород и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Рита смертина
Металлы- это химические элементы, на внешнем энергитическом уровне которых на ходится 1, 2, 3 электрона, которые они отдают, проявляя металлические или восстановительные свойства и превращаясь в положительно заряженные ионы- катионы.
Неметаллы- это химические элементы, на внешнем энергитическом уровне которых находится 4, 5, 6, 7 эллектронов, поэтому они их принимают проявляя неметаллические или окислительные свойства.
Читайте также
![Акт определение Акт определение]() Акт определение
Акт определение![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Дайте определение понятию авария Дайте определение понятию авария]() Дайте определение понятию авария
Дайте определение понятию авария![Генетическое определение пола кратко Генетическое определение пола кратко]() Генетическое определение пола кратко
Генетическое определение пола кратко![Генетические механизмы определения пола Генетические механизмы определения пола]() Генетические механизмы определения пола
Генетические механизмы определения пола- Актив определение
![Гражданское право определение Гражданское право определение]() Гражданское право определение
Гражданское право определение![Двигатель определение Двигатель определение]() Двигатель определение
Двигатель определение![Деталь определение Деталь определение]() Деталь определение
Деталь определение![Закон джоуля ленца формула и определение Закон джоуля ленца формула и определение]() Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение![Земля определение Земля определение]() Земля определение
Земля определение![Что такое сила в физкультуре определение Что такое сила в физкультуре определение]() Что такое сила в физкультуре определение
Что такое сила в физкультуре определение
 Акт определение
Акт определение Болезнь определение
Болезнь определение Дайте определение понятию авария
Дайте определение понятию авария Генетическое определение пола кратко
Генетическое определение пола кратко Генетические механизмы определения пола
Генетические механизмы определения пола Гражданское право определение
Гражданское право определение Двигатель определение
Двигатель определение Деталь определение
Деталь определение Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение Земля определение
Земля определение Что такое сила в физкультуре определение
Что такое сила в физкультуре определение