Зачем нам нужно знать pH воды?
Как все мы помним из школьного курса химии, pH – это единица активности иона водорода, равная обратному логарифму активности водородных ионов. Таким образом, вода с показателем рН, равным 7, имеет 10-7 моль на литр ионов водорода, а вода с рН 6 – 10-6 моль на литр. Шкала значений рН может варьировать в диапазоне от 0 до 14.
В целом вода с pH меньше 7 считается кислой, а с рН больше 7 – щелочной. Нормальный диапазон pH для поверхностных водных систем лежит в пределах от 6,5 до 8,5, а для подземных систем – от 6 до 8,5.

Значение pH воды (H20) равно 7 при 25 °C , но при контакте с диоксидом углерода в атмосфере это равновесие смещается к pH - приблизительно 5,2. Из-за тесной связи pH с атмосферными газами и температурой настоятельно рекомендуется, чтобы вода была проверена как можно быстрее. Ведь pH воды не является мерой устойчивости кислой или щелочной реакции и не дает полной картины характеристик или повода для ограничения водоснабжения.
Мягкая вода
В целом вода с низким pH (меньше 6,5) является кислой, мягкой и коррозивной. Таким образом, в воду могут проникать ионы металлов, таких как: железо, марганец, медь, свинец и цинк из водоносного горизонта, сантехники и трубопроводов. Поэтому вода с низким pH может:
- содержать повышенные уровни токсичных металлов;
- привести к преждевременному повреждению металлических труб;
- иметь металлический или кислый привкус;
- окрашивать белье;
- иметь характерное "сине-зеленое" окрашивание раковины и стоков.
Основной способ решения проблемы низкого pH воды является использование нейтрализатора. Он подает раствор в воду, чтобы предотвратить реакцию воды с домашним водопроводом или электролитическую коррозию. Типичный нейтрализатор – химическая кальцинированная сода. Нейтрализация этим средством увеличивает содержание натрия в воде.

Жесткая вода
Вода с pH выше 8,5 является жесткой. Она не представляет опасности для здоровья, но может вызвать эстетические проблемы. Эти проблемы включают в себя:
- Формирование "шкалы" или осадка на трубопроводах и светильниках.
- Щелочной привкус в воде, который может сделать вкус кофе горьким.
- Образование накипи на посуде, стиральной машине, бассейнах.
- Сложность в получении пены из мыла и моющих средств и образование нерастворимых осадков на одежде и т. д.
- Уменьшение эффективности электрических водонагревателей.
Как правило, эти проблемы возникают, когда жесткость варьируется в пределах от 100 до 200 миллиграмм CaCO3/л, что эквивалентно 12 граммам на галлон. Вода может быть смягчена за счет использования ионного обмена или добавлением золы, известково-содовой смеси, но оба процесса увеличивают содержание натрия в воде.
PH питьевой воды

Пристальное внимание к контролю pH необходимо на всех этапах водоподготовки для обеспечения удовлетворительного качества и обеззараживания воды. Хотя pH воды обычно не имеет прямого влияния на потребителей, это один из самых важных эксплуатационных параметров качества воды. Для эффективной дезинфекции с хлором показатель pH предпочтительно должен быть меньше, чем 8. PH воды на входе в систему распределения необходимо контролировать, чтобы свести к минимуму коррозию труб. Невыполнение этого требования может привести к загрязнению питьевой воды и неблагоприятным последствиям для ее вкуса, запаха и внешнего вида.
Оптимальное значение pH будет варьироваться для разных материалов в зависимости от состава воды и природы строительных материалов, используемых в системе распределения, но чаще всего оно лежит в диапазоне 6,5-9,5. Экстремальные значения pH могут быть результатом случайных разливов, поломок на очистных сооружениях.
Идеальный уровень pH ионизированной воды для долгосрочного употребления человеком находится между 8,5 и 9,5 (и никогда не превышает 10,0) с идеальным значением ОВП около 200mV-300mV (и ни в коем случае не выше 400mV).
PH воды в бассейне

Как уже упоминалось выше, pH – важнейшая характеристика не только для питьевой воды, но и для бассейнов, поскольку для дезинфекции воды все еще в основном применяют хлорирование, а при использовании хлора эффективность дезинфекции сильно зависит от исходного значения pH воды.
Хлор является основным дезинфицирующим агентом для предупреждения развития инфекций в общественных бассейнах, но хлор также реагирует с органическими веществами в воде и образует побочные продукты дезинфекции (ППД): органические вещества – производное гуминовых веществ, образующихся в результате взаимодействия воды с потом, мочой, волосами, клетками кожи и остатками средств личной гигиены, попадающих в воду от пловцов. Содержание ППД может быть измерено в виде суммы всех галогенированных соединений. Некоторые ППД увеличивают риск развития астмы, являются канцерогенами или раздражают глаза и кожу.
Хлор является общим названием хлористой кислоты, которая образует газообразный хлор, реагирующий с водой. Растворяясь в воде, кислота образует гипохлорит и имеет значение рКа, равное 7,5.
Хлористая кислота является гораздо более эффективной, чем гипохлорит, убивая бактерии, цисты, споры и неактивные вирусные. Таким образом, если значение pH в плавательном бассейне находится на нижнем уровне регулируемого диапазона, меньшее количество хлора необходимо получить для той же степени дезинфекции, а следовательно, в воде образуется меньше потенциально опасных ППД. Как показывают многочисленные исследования, оптимальный уровень pH воды в бассейне лежит в пределах от 7,5 до 8,0. При снижении pH всего на 1-0,5 единицы (до 7,0-6,5) значительно повышается уровень ППД, которые к тому же еще и геннотоксичны.
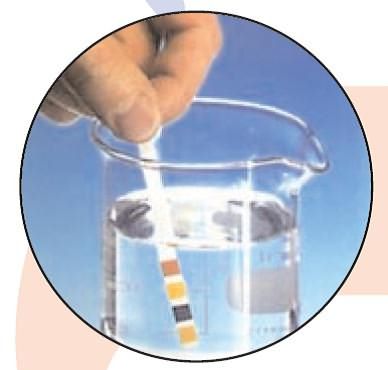
Методы определения pH
Шкала pH является логарифмической шкалой, что означает, что каждое увеличение или уменьшение на 1 единицу представляет собой изменение с коэффициентом 10. Например, раствор с pH 11 в 10 раз более щелочной, чем раствор с pH 10. Существует несколько методов, как определить pH воды.
Определение pH с помощью тест-полосок
Тест-полоски представляют собой лакмусовую бумагу, реагирующую изменением цвета на колебания pH. Приобрести их можно в зоомагазинах, поскольку часто их используют для определения pH воды в аквариумах (даже незначительное колебание этого показателя может привести к гибели рыб).

При контакте с водой цвет тест-полоски изменится. Вам придется только лишь сравнить итоговый цвет с образцом цветовой шкалы на упаковке и получить конкретное значение. Этот метод определения pH быстр, прост, дешев, но имеет достаточно большую погрешность.
Лакмусовая бумага «Роттингер»
Приобрести лакмусовые бумажки в магазинах медтехники вашего города. Проведя анализ различных ph тестов (начиная от дешевых китайских и заканчивая дорогими голландскими), мы пришли к выводу, что минимальную погрешность в показании дают немецкие ph полоски «Роттингер». В упаковке идет индикаторная шкала от 1 до14 (максимальный доступный интервал!) и 80 ph полосок, которых хватает на долгое время. С помощью данных полосок можно измерить не только ph воды, но и ph таких биологических жидкостей, как слюна, моча и тд. Так как хорошие ph метры достаточно дорогие (около 3000руб), и для них приходится покупать буферные растворы для калибровки , то лакмусовая бумага «Роттингер» , цена которой не превышает 250-350 руб., послужит вам незаменимым помощником в точном определении уровня ph.

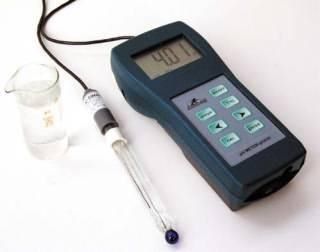
Определение pH с помощью pH-метра
В пластиковый или стеклянный стаканчик отбирают пробу воды (20-30 мл). Датчик прибора ополаскивают небольшим количеством дистиллированной воды, а затем погружают в раствор вместе с датчиком температуры. Шкала прибора показывает вам точное значение pH исследуемого раствора. При этом следует учитывать, что на точность измерений влияет регулярная калибровка прибора, для которой используют стандартные растворы с известной величиной pH. Этот метод определения pH точен, прост, быстр, но требует больших материальных затрат по сравнению с предыдущим и простейших навыков работы с лабораторным оборудование и химическими растворами.
Таким образом, pH воды – это не просто термин из школьного курса химии, но и показатель качества воды, который должен контролироваться во избежание возникновения проблем с оборудованием и здоровьем.
fb.ru
/ работа с 1заоч лаб раб ВПООС / Определение рН в природных и сточных водах
Министерство образования и науки Российской Федерации
федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Северный (Арктический) федеральный университет имени М.В. Ломоносова»
|
Институт энергетики и транспорта |
|
|
Кафедра теплоэнергетики и теплотехники |
|
|
13.03.02 Электроэнергетика и электротехника |
|
|
(код и наименование направления подготовки/специальности) |
|
Лабораторная работа №2 ОПРЕДЕЛЕНИЕ рН В ПРИРОДНЫХ И СТОЧНЫХ ВОДАХ
Водородным показателем (рН) называется величина, равная отрицательному десятичному логарифму концентрации ионов водорода:
РН=-lg(CH+)
Если CH+=10-7моль/л, то рН=7 – среда нейтральная;
если CH+>10-7моль/л, то рН
если CH+-7моль/л, то рН>7 – среда щелочная.
Возможный диапазон изменения рН=014. В большинстве природных вод рН=6,58,5. При сбросе сточных вод в канализацию или в водоемы, рН также должна быть в этих пределах. В противном случае может иметь место повышенная коррозия труб, а также гибель или уменьшение биомассы на очистных сооружениях.
|
Значения pH для некоторых известных веществ |
|||
|
Вещество |
pH |
Вещество |
pH |
|
Желудочный сок |
1,0—2,0 |
Кислотный дождь |
< 5,6 |
|
Лимонный сок (5% р-р лимонной кислоты) |
2,0±0,3 |
Слюна |
6,8–7,4 |
|
Пищевой уксус |
2,4 |
Молоко |
6,6-6,9 |
|
Кока-кола |
3,0±0,3 |
Чистая вода |
7,0 |
|
Яблочный сок |
3,0 |
Кровь |
7,36—7,44 |
|
Пиво |
4,5 |
Морская вода |
8,0 |
|
Кофе |
5,0 |
Мыло (жировое) для рук |
9,0—10,0 |
|
Шампунь |
5,5 |
Нашатырный спирт |
11,5 |
|
Чай |
5,5 |
Отбеливатель (хлорная известь) |
12,5 |
|
Кожа здорового человека |
5,5 |
Концентрированные растворы щелочей |
>13 |
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
-
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.
-
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
-
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Устройство и работа pH- метра pH-410
Принцип работы приборов основан на измерении разности потенциалов в электродной системе при контроле температуры раствора датчиком температуры.
Прибор состоит из преобразователя и электродной системы. Электродная система может включать измерительный и сравнительный электроды или комбинированный электрод. Электронная плата внутри корпуса выполняет функции измерения поступающего сигнала, его усиления, преобразования, математической обработки, вывода выходного сигнала на дисплей.
Электрод сравнения - хлорсеребряный электрод с электрическим сопротивлением не более 20 кОм.
Измерительный электрод - стеклянный электрод с допускаемой величиной электрического сопротивления от 10 до 1000 МOм используют при измерениях pH.
Комбинированные электроды используются для контроля объектов окружающей среды, продукции и параметров технологических процессов в промышленности. Комбинированные электроды могут быть оснащены дополнительными устройствами для измерения рН в вязких и плотных средах.
Калибровку прибора выполняют с каждым измерительным электродом по растворам стандарт-титров. В памяти прибора сохраняются данные только последней калибровки.
Редоксметрический (платиновый) измерительный электрод используют при измерениях окислительно-восстановительного потенциала Eh.
В качестве датчика температуры (термокомпенсатора) используется термосопротивление.
Общий вид pH- метра
Режим калибровки прибора с электродной системой
Калибровку прибора выполняют по двум калибровочным растворам [РТ1] и РТК2], значения рН которых находится вблизи нижней [РТ1] и верхней [РТ2] границ диапазона.
Калибровку следует производить по возможности чаще, а при смене измерительного электрода обязательно.
Электроды, подготовленные в соответствии с паспортом, погружают в первый калибровочный раствор [РТ1]. Включают прибор нажатием кнопки «On/Off». На дисплее индицируется результат измерения ЭДС раствора в mV.
Режим калибровки включают нажатием и удерживанием около 5 секунд кнопки «CAL». На дисплее появляется значение рН первого калибровочного раствора [РТ1].
Нажатием кнопок «влево», «вправо» выбирают одно из стандартных значений рН первого калибровочного раствора [РТ1], заложенных в память прибора (например, 4.01 рН).
Если значение рН первого калибровочного раствора [РТ1] не соответствует ни одному из стандартных значений введенных в память прибора (например, требуется ввести 4.5 рН), то удерживанием кнопок «влево», «вправо» его можно установить.
Нажимают кнопку «ENTER» для подтверждения значения рН первого калибровочного раствора [РТ1]. Прибор автоматически переходит в режим измерения ЭДС первого калибровочного раствора [РТ1].
Необходимо дождаться установления показаний, после чего нажимают клавишу «ENTER» для ввода значения ЭДС первого калибровочного раствора [РТ1] в память преобразователя.
После того, как в память прибора было введено э.д.с. первого калибровочного раствора [РТ1] электродную систему промывают дистиллированной водой, остатки воды удаляют фильтровальной бумагой. Электроды, подготовленные в соответствии с паспортом, погружают во второй калибровочный раствор [РТ2]. Повторяют описанные выше операции.
После ввода значения ЭДС второго калибровочного раствора [РТ2] в память преобразователя на дисплее индицируется значение крутизны водородной характеристики применяемого электрода.
Прибор переходит в режим измерения рН раствора в который погружена электродная система.
Выполнение измерений рН
Датчик температуры и электроды погружают в измеряемую среду. Нажатием кнопки «On/Off» включают прибор. На дисплее прибора отображается результат измерения ЭДС раствора в мВ.
Нажатием кнопки «mV/pH» выбирают режим измерений рН. Проводят измерение. Показания прибора - результат измерения в рН отображается на дисплее. Результаты регистрируют после установления стабильного значения.
Перевод прибора в режим измерения окислительно-восстановительного потенциала осуществляют нажатием кнопки «mV/pH», не входя в режим калибровки.
После (или в процессе) получения результатов измерений, при необходимости, можно перейти в режим измерения температуры раствора, нажав кнопку «ToC». На дисплее появляется результат измерения температуры раствора в 0С.
Нажатием клавиши «On/Off» выключают прибор.
По окончании работы электроды промывают дистиллированной водой.
Измеренные начения pH
|
Образец № |
Вещество |
pH |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
|
5 |
||
|
6 |
||
|
7 |
StudFiles.ru
Водородный показатель среды растворов – pH.
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
pН = – lg[H+]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni – сила водорода, или pondus hydrogenii – вес водорода.
Несколько меньшее распространение получила обратная pH величина – показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
рОН = – lg[OH–]
В чистой воде при 25°C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7моль/л, это напрямую следует из константы автопротолиза воды Кw , которую иначе называют ионным произведением воды:
Кw = [H+] · [OH–] =10–14 [моль2/л2] (при 25°C)
рН + рОН = 14
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH–] говорят, что раствор является кислым, а при [OH–] > [H+] – щелочным.
Определение рН
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах – либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора – pH-метра – позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также – для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
| Система (раствор) | рН |
| Двенадцатиперстная кишка | 7,0 – 7,8 |
| Желудочный сок | 1,6 – 1,8 |
| Кровь человека | 7,35 – 7,45 |
| Ликвор | 7,5 |
| Моча | 4,8 – 7,5 |
| Мышечная ткань | 6,7 – 6,8 |
| Панкреатический сок | 8,3 |
| Пот | 4,0 – 8,0 |
| Почки | 6,6 – 6,9 |
| Протоплазма клеток | 6,4 – 7,0 |
| Связки | 7,2 |
| Слёзы | 7,4 |
| Слюна | 6,35 – 6,85 |
| Тонкая кишка | 6,2 – 7,3 |
| Молоко | 6,6 – 6,9 |
| Морская вода | 8,0 |
| Белок куриного яйца | 8,0 |
| Апельсиновый сок | 2,6 – 4,4 |
| Томатный сок | 4,3 |
| Кофе | 5,0 |
| Чай | 5,5 |
Контрольные вопросы
1. Уравнение ионного произведения воды, его анализ.
2. Водородный и гидроксильный показатели среды.
3. Характеристика кислотности сред по величине pH.
4. Биологическое значение водородного показателя.
Типовые задачи
Задача 1. Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм-3.
Дано: Решение:
 С(HCl) = 0,001 моль·дм-3 HCl H+ + Cl-, т.к. = 1, то
С(HCl) = 0,001 моль·дм-3 HCl H+ + Cl-, т.к. = 1, то
 [H+] = [HCl] = 10-3 моль·дм-3
[H+] = [HCl] = 10-3 моль·дм-3
рН - ? pH = -lg [H+]
pH = -lg10-3 = 3
Ответ: pH = 3.
Задача 2. Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·дм-3.
Дано: Решение:
 С(KOH) = 1,5·10-2 моль·дм-3 KOH K+ + OH-, т.к. = 1, то
С(KOH) = 1,5·10-2 моль·дм-3 KOH K+ + OH-, т.к. = 1, то
 [OH-] = [KOH] = 1,5·10-2 моль·дм-3
[OH-] = [KOH] = 1,5·10-2 моль·дм-3
рН -? pOH = –lg[OH-]
pOH = –lg1,5·10-2 = 1,82
pH + pOH = 14 pH = 14 – pOH
pH = 14 – 1,82 = 12,18.
Ответ:pH = 12,18.
Задача 3. pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке.
Дано: Решение:
 pH = 1,65 pH = –lg [H+]
pH = 1,65 pH = –lg [H+]
 lg [H+] = –pH [H+] = 10–pH
lg [H+] = –pH [H+] = 10–pH
[H+] - ? [H+] = 10–1,65 = 0,0224 моль·дм–3 = 2,24·10–2 моль·дм–3
 |
[OH-] - ? [H+] · [OH-] = 10–14
Ответ: [H+] = 2,24·10–2 мольˑдм–3; [OH–] = 4,46·10–13 мольˑдм–3 .
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. КОНЦЕНТРАЦИЯ ИОНОВ ОН— (МОЛЬ/ДМ3) В РАСТВОРЕ ПРИ рН = 2,00 РАВНА ________МОЛЬ/ДМ3
1) 10–10
2) 10–2
3) 10–12
4) 10–4
02. ЗНАЧЕНИЯ С(ОН—) И С(Н+ ) В РАСТВОРЕ ПРИ рН = 5,0 СОСТАВЛЯЮТ______ МОЛЬ/ДМ3
1) 10–5 и 10 –9
2) 10–4 и 10 –10
3) 10–10 и 10 –4
4) 10–9 и 10 –5
03. ЗНАЧЕНИЯ С(ОН—) И С(Н+ ) В РАСТВОРЕ ПРИ рОН = 6,0 СОСТАВЛЯЮТ ______ МОЛЬ/ДМ3
1) 10–8 и 10–6
2) 10–4 и 10–10
3) 10–6 и 10–8
4) 10–7 и 10–7
04. УКАЖИТЕ рН СОЛЯНОЙ КИСЛОТЫ С КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ/Л И ВОДНОГО РАСТВОРА ГИДРОКСИДА КАЛИЯ С КОНЦЕНТРАЦИЕЙ 1,0 МОЛЬ/Л, СЧИТАЯ, ЧТО УКАЗАННЫЕ ВЕЩЕСТВА ДИССОЦИИРУЮТ ПОЛНОСТЬЮ
1) 1 и 14
2) 7 и 7
3) 14 и 0
4) 2 и 12
05. В РАСТВОРЕ АЗОТНОЙ КИСЛОТЫ С рН = 2 КОНЦЕНТРАЦИЯ ВЕЩЕСТВА ПРИ α = 100% РАВНА _____ МОЛЬ/ДМ3
1) 0,05
2) 0,1
3) 0,01
4) 0,001
06. рН РАСТВОРА ГИДРОКСИДА БАРИЯ РАВЕН 13, КОНЦЕНТРАЦИЯ ОСНОВАНИЯ В НЕМ ПРИ α =100% РАВНА ______ МОЛЬ/ ДМ3
1) 0,005
2) 0,1
3) 0,05
4) 0,001
07. РАСТВОР, В 500 МЛ КОТОРОГО РАСТВОРЕНО 1,825 г HCl, ИМЕЕТ рН, РАВНЫЙ
1) 2
2) 4
3) 5
4) 1
08. УКАЖИТЕ рН 0,003 МОЛЯРНОГО РАСТВОРА СОЛЯНОЙ КИСЛОТЫ
1) 11,5
2) 3
3) 7
4) 2,5
Контрольные задания
09. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет
1,78·10–7 моль·дм-3.
10. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H+] и [OH-] в крови.
11. Рассчитать рН раствора соляной кислоты с концентрацией 0,03 моль/дм3 и водного раствора гидроксида калия с концентрацией 0,12 моль/дм3, считая, что указанные вещества диссоциируют полностью.
12. Определите рН кишечного сока, если концентрация гидроксид- анионов ОН- в составе кишечного сока составляет 2,3·10-6 моль·дм-3.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 66 – 76, 101 – 107.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.45-50.
1.8. Буферные системы
Свойством всех живых организмов является постоянство рН биологических жидкостей, тканей и органов. Это постоянство поддерживается их буферными системами и необходимо для обеспечения нормальной деятельности ферментов, регулирования осмотического давления и других показателей.
Знания по теме «Буферные «системы» необходимы для понимания механизма их действия, количественной оценки способности буферных систем связывать посторонние кислоты и щелочи, понимания их взаимосвязи и роли в поддержании кислотно-основного гомеостаза.
Кроме того, важно уметь готовить буферные растворы для последующего использования их в различных медико-биологических, химических и клинических исследованиях.
Буферными называют системы, состоящие из двух сопряженных компонентов, способных до определенного предела противодействовать изменению рН среды при добавлении к ним небольших количеств кислоты и щелочи, а также при разбавлении раствора или концентрировании.
Способность буферных систем сохранять постоянство pH называется буферным действием.
По составу, с точки зрения протонной теории, буферные системы делят на кислые и основные.
Кислые буферные системы состоят из слабой кислоты и сопряженного с ней избытка сильного основания, создаваемого солью этой кислоты.
Например: Ацетатная буферная система – кислая буферная система, состоит из:
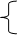 СН3СООН – слабая кислота;
СН3СООН – слабая кислота;
СН3СООNa – растворимая соль (содержит сопряженное сильное основание СН3СОО- ).
Аммиачная буферная система – основная буферная система, состоит из:
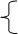 NН4ОН – слабое основание;
NН4ОН – слабое основание;
NН4Сl –растворимая соль (содержит сопряженную сильную кислоту NН4+).
Буферные системы в растворенном состоянии образуют буферные растворы.
Буферные растворы, в отличие от буферных систем, могут быть многокомпонентными.
Кровь относят к буферным растворам.
Водородный показатель среды буферного раствора рассчитывают по уравнению Гендерсона-Гассельбаха:
pH = pKa + lg[соль]/[кислота]
pH - водородный показатель среды буферного раствора,
pKa – показатель константы кислотности слабой кислоты,
[соль]/[кислота]– количества соли и кислоты в момент равновесия; буферное соотношение.
В рабочем виде: 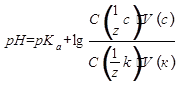
- C (1/z с), C (1/z к) – исходные молярные концентрации эквивалентов соли и кислоты, моль·дм-3;
- V (с), V (к) – объемы растворов соли и кислоты соответственно, см3.
Величину, характеризующую способность буферной системы противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью (B). Буферную ёмкость можно определить по кислоте или по основанию.
Буферная ёмкость показывает сколько моль-эквивалентов сильной кислоты или щелочи следует добавить к 1 дм3 буферного раствора, чтобы изменить его рН на единицу.
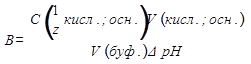 |
B – буферная ёмкость, моль дм-3;
C(1/z кисл.; осн.) – молярная концентрация эквивалента добавляемой кислоты или основания;
V(кисл.; осн.) – объем раствора добавляемой кислоты или основания, см3;
∆pH – изменение pH;
V (буф.)- объем буферного раствора, см3.
Для сохранения оптимальных условий обменных процессов необходимо постоянство pH внутренних сред организма. Постоянство кислотности сред, наряду с физиологическими механизмами поддерживается буферными системами организма.
Контрольные вопросы
1. Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы
2. Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
3. Буферная емкость. Факторы, влияющие на величину буферной емкости.
4. Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
5. Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
Типовые задачи
Задача 1. Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0,1 н раствора СН3СООН и 20 мл 0,1 н раствора СН3СООNa. КД (СН3СООН) = 1,74 · 10– 5.
| Дано: | Решение: |
| С (СН3СООН) = 0,1 н | 1. Находим рКкислоты: рКкислоты = – lgКД = – lg 1,74 · 10– 5 = 4,76 |
| Vр (СН3СООН) = 80 мл = 0,08 л | |
| С (СН3СООNa) = 0,1 н | 2. Находим рН ацетатного буферного раствора: |
| Vр (СН3СООNa) = 20 мл | |
| КД (СН3СООН) = 1,74 · 10– 5 | CC · VC 0,02 · 0,1 рН = рКкислоты + lg ----------- = 4,76 + lg -------------- = 4,16 CК · VК 0,08 · 0,1 |
| -------------------------------------- | |
| рН = ? | |
| Ответ: рН = 4,16 |
Задача 2. Рассчитать рН оксалатной буферной системы, состоящей из100 см3 раствора щавелевой кислоты с концентрацией С(1/2 Н2С2О4)=0,5 моль·дм -3 и 150 см3 растворы оксалата натрия с концентрацией С(1/2 Na2C2O4)=0,25 моль·дм-3,если КД (Н2С2О4)=5,6·10-2.
 Дано: Решение:
Дано: Решение:
V (H2C2O4) = 100см3 рН=рКД+lgC(1/2H2C2O4)·V(Na2C2O4)/C(1/2H2C2O4)·V(H2C2O4)
С(Na2C2O4) = 0,5 моль·дм– 3 pКд = – lgКд
V(Na2C2O4) = 150 см3 pКд = – lg 5,6·10-2 = 1,25
С(1/2Na2C2O4) = 0,25 моль·дм– 3 рН = 1,25 + lg(0,25·150)/(0,5·100 )= 1,125.
КД (H2C2O4) = 5,6·10– 2
рН-? Ответ: рН = 1,125.
Задача 2. Рассчитайте объемы (см3) 0,1М СН3СООН и 0,1 М СН3СООNa, необходимые для приготовления 100 см3 буферного раствора с рН = 4,0. рК (СН3СООН) = 4,76
| Дано: | Решение: |
| C(СН3СООН) = 0,1моль/дм3 | 1. По уравнению Гендерсона-Гассельбаха : |
| C(СН3СООNa) = 0,1моль/дм3 | рН = рК + lg (Cс·Vс)/(Cк·Vк) |
| Vбуф. = 100 см3 | lg(Cс·Vс)/(Cк·Vк) = pH – pK |
| рН = 4,0 | 2. Подставим данные: |
| рК (СН3СООН) = 4,76 | lg(0,1·Vс)/(0,1·Vк) = 4 – 4,76 = –0,76 |
| V(СН3СООН) = ? V(СН3СООNa) = ? | 3. Vс + Vк = 100 см3 lg Vс/(100 –Vc) = –0,76 |
| Vс/(100 –Vc) = 10 -0,76 = 0,174 Vc = 14,84 см3 Vк = 100 – 14,84 = 85,16 см3 | |
| Ответ: V(СН3СООН) = 85,16 см3; V(СН3СООNa) = 14,84 см3 |
Задача 3. Рассчитайте рН фосфатного буфера, состоящего из 100 см3 0,01 моль/дм3 NaH2PO4 и 20 см3 0,1 моль/дм3 Na2HPO4. Как изменится рН при добавлении к этой смеси 30 мл раствора NaOH с молярной концентрацией С(NaОН) = 0,02 моль/дм3?
КД (Н2РО-4)=1,6·10– 7.
| Дано: | Решение: |
| C(NaH2PO4) = 0,01моль/дм3 | 1. По уравнению Гендерсона-Гассельбаха : |
| C(Na2HPO4) = 0,1моль/дм3 | рН = рК(H2PO4–) + lg (Cс·Vс)/(Cк·Vк) |
| V(NaH2PO4) = 100 см3 | pK (H2PO4–) = – lg1,6·10– 7 = 6,8 |
| V(Na2HPO4) = 20 см3 | 2. Подставим данные: |
| V(NaOН) = 30 см3 | pH = 6,8 + lg(0,1·20)/(0,01·100) = 6,8 + lg2 = 7,1 |
| C(NaОН) = 0,02моль/дм3 | 3. Роль соли (основания) в буфере выполняет Na2HPO4, а роль кислоты – NaH2PO4 H2PO4– + OH– ↔ HPO42– + H2O; HPO42– + Н+ ↔ H2PO4– кислота основание |
| КД (Н2РО-4)=1,6·10-7 рН = ? | |
| При добавлении NaOH в буфере уменьшится количество кислоты NaH2PO4 и увеличится количество соли Na2HPO4. Расчет ведем в миллимолях(ммоль) n(NaOH) = 30 мл · 0,02 = 0,6ммоль | |
| рН = 6,8 + lg(2+0,6)/(1-0,6) = 6,8 + lg(2,6/0,4) = 7,615 | |
| Ответ: рН = 7,615 |
Задача 4. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 см3 гидрокарбонатного буфера с рН = 6,5 10 см3 раствора НСl с молярной концентрацией эквивалента С(НСl) = 0,1 моль/дм3 изменился до 6,3.
| Дано: | Решение: |
| C(НСl) = 0,1 моль/дм3 | 1. По уравнению: |
| V(НСl) = 10 см3 | Bк = V(HCI)·С(НСl) /Vбуф. ·ΔpH |
| Vбуф. = 100 см3 | Bк = 10 · 0,1 / 100 · (6,5 – 6,3) = 0,05 моль/дм3 |
| рН1 = 6,5 | |
| рН2 = 6,3 | |
| Вк = ? | |
| Ответ: Bк = 0,05 моль/дм3 |
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. ВЫБЕРИТЕ БУФЕРНУЮ СИСТЕМУ
1) KH2PO4/Na2HPO4
2) HCl / NaCl
3) H2SO4/ Na2SO4
4) NaHSO4/ Na2SO4
02. УКАЖИТЕ КАК НАЗЫВАЕТСЯ СДВИГ РЕАКЦИИ СРЕДЫ ОРГАНИЗМА В ЩЕЛОЧНУЮ СТОРОНУ
1) ацидоз
2) алкалоз
3) алкалемия
4) изогидрия
studopedia.ru
Как определить ph воды в аквариуме?
Dangerous
Вода аквариума. Аквариум вода
Вода является жизненным пространством для рыб и растений, так же как и воздух для человека является жизненным пространством. В зависимости от свойств вода способствует развитию жизненных процессов или тормозит их. Вода содержит вещества, придающие ей такие свойства как, как цвет, прозрачность, запах, а также значения жесткости dH и водородного показателя pH. Для аквариума пригодна чистая, прозрачная, содержащая все необходимые для растений микроэлементы водопроводная вода с dH 5-20%, KH 2-15 градусов, pH 6,5-7,5. Но такая вода содержит чрезмерное количество воздуха и хлора. Поэтому она должна отстаиваться 3-4 дня. Бывает встает вопрос, где достать воду людям, живущим без водопровода, например, в сельской местности. Ответ: воду в таких местностях можно брать из чистых ручьев, родников, колодцев. Кроме того, там не должно быть вредных соединений: серный водород, минеральные соли, оксид железа. После заливки новой воды в аквариум в воде происходят различные процессы. Из-за этого вода может стать беловато-мутной, но вскоре она опять становится прозрачной. Если наклониться над нормально функционирующим аквариумом, то чувствуется легкий запах растений. Всякий другой запах указывает на неблагополучие процессов, проходящих в аквариуме. В этом случае нужно провести основательную чистку грунта и части воды. Хорошая вода - это вода богатая кислородом, свободная от органических отходов, лишенная пузырьков газа и хлора, отфильтрованная от нечистот и мути.
Вода аквариума. Кислотность воды (pH).
Такой параметр как кислотность воды оказывает большое влияние на биохимические и биологические процессы и имеет важное значение в жизни рыб. В зависимости от кислотности вода классифицируется так: pH = 1-3 сильнокислотная вода 3-5 кислая вода 5-6 слабокислая вода 7 нейтральная вода 7-8 очень слабощелочная вода 8-9 слабощелочная вода 9-10 щелочная вода 10-14 сильнощелочная вода. Кислотность водопроводной воды примерно 7pH. Многие рыбы вполне безболезненно переносят отклонения от нейтрального показателя (7). Это объясняется тем, что организм имеет целый ряд систем, сглаживающих резкие колебания pH. В процессах фотосинтеза, протекающих на свету, растения потребляют углекислый газ, что повышает уровень pH, а ночью понижается, что связано не только с отсутствием фотосинтеза, но и с выделением CO2 при дыхании растений. Вообще, в аквариумах биологические процессы окисления преобладают над процессами восстановления; в связи с этим кислотность воды со временем понижается. Для содержания аквариумных рыб не годится сильнокислая, кислая, щелочная и сильнощелочная вода. Вода должна быть слабокислой, нейтральной, очень слабощелочной. Резкое изменение кислотности воды может стать причиной гибели рыб. Чтобы этого избежать, следует менять воду небольшими порциями и наливать воду нужно небольшими порциями. Переносить рыб из аквариума в аквариум надо тоже осторожно. Повысить уровень pH(сделать более щелочной) . Повысить уровень можно с помощью питьевой воды, т. е. добавить в воду питьевой воды. Также можно добавить немного бикарбоната натрия или смешать ее со щелочной водопроводной водой. Чтобы повысить уровень pH до значения 7, т. е. сделать ее нейтральной, следует производить ее аэрацию или прокипятить. Понизить уровень pH (сделать ее более кислой) . Можно добавить в воду немного торфа, взятый на возвышенностях или отфильтрованный экстракт, получившийся после кипячения торфа. Также можно подкислить воду с помощью бифосфата натрия. Измерить уровень pH. Измерить уровень в домашних условиях можно применением индикаторных бумаг. Определение сводится к опусканию полоски индикаторной бумаги в аквариумную воду и быстрому сравнению приобретенной окраски со стандартной шкалой. Существует индикаторная бумага как для грубых измерений pH от 1 до 10, так и для более точного определения pH в любом из узких диапазонов.
Читайте также
![Акт определение Акт определение]() Акт определение
Акт определение![Двигатель определение Двигатель определение]() Двигатель определение
Двигатель определение![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Определение цены деления шприца Определение цены деления шприца]() Определение цены деления шприца
Определение цены деления шприца![Определение высоты объекта Определение высоты объекта]() Определение высоты объекта
Определение высоты объекта![Обжалование определения Обжалование определения]() Обжалование определения
Обжалование определения![Легальное определение юридического лица дано Легальное определение юридического лица дано]() Легальное определение юридического лица дано
Легальное определение юридического лица дано![Деталь определение Деталь определение]() Деталь определение
Деталь определение![Закон джоуля ленца формула и определение Закон джоуля ленца формула и определение]() Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение![Машина определение Машина определение]() Машина определение
Машина определение![Места массового скопления людей определение Места массового скопления людей определение]() Места массового скопления людей определение
Места массового скопления людей определение![Определение надежности Определение надежности]() Определение надежности
Определение надежности
 Акт определение
Акт определение Двигатель определение
Двигатель определение Болезнь определение
Болезнь определение Определение цены деления шприца
Определение цены деления шприца Определение высоты объекта
Определение высоты объекта Обжалование определения
Обжалование определения Легальное определение юридического лица дано
Легальное определение юридического лица дано Деталь определение
Деталь определение Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение Машина определение
Машина определение Места массового скопления людей определение
Места массового скопления людей определение Определение надежности
Определение надежности