Зачем нам нужно знать pH воды?
Как все мы помним из школьного курса химии, pH – это единица активности иона водорода, равная обратному логарифму активности водородных ионов. Таким образом, вода с показателем рН, равным 7, имеет 10-7 моль на литр ионов водорода, а вода с рН 6 – 10-6 моль на литр. Шкала значений рН может варьировать в диапазоне от 0 до 14.
В целом вода с pH меньше 7 считается кислой, а с рН больше 7 – щелочной. Нормальный диапазон pH для поверхностных водных систем лежит в пределах от 6,5 до 8,5, а для подземных систем – от 6 до 8,5.

Значение pH воды (H20) равно 7 при 25 °C , но при контакте с диоксидом углерода в атмосфере это равновесие смещается к pH - приблизительно 5,2. Из-за тесной связи pH с атмосферными газами и температурой настоятельно рекомендуется, чтобы вода была проверена как можно быстрее. Ведь pH воды не является мерой устойчивости кислой или щелочной реакции и не дает полной картины характеристик или повода для ограничения водоснабжения.
Мягкая вода
В целом вода с низким pH (меньше 6,5) является кислой, мягкой и коррозивной. Таким образом, в воду могут проникать ионы металлов, таких как: железо, марганец, медь, свинец и цинк из водоносного горизонта, сантехники и трубопроводов. Поэтому вода с низким pH может:
- содержать повышенные уровни токсичных металлов;
- привести к преждевременному повреждению металлических труб;
- иметь металлический или кислый привкус;
- окрашивать белье;
- иметь характерное "сине-зеленое" окрашивание раковины и стоков.
Основной способ решения проблемы низкого pH воды является использование нейтрализатора. Он подает раствор в воду, чтобы предотвратить реакцию воды с домашним водопроводом или электролитическую коррозию. Типичный нейтрализатор – химическая кальцинированная сода. Нейтрализация этим средством увеличивает содержание натрия в воде.

Жесткая вода
Вода с pH выше 8,5 является жесткой. Она не представляет опасности для здоровья, но может вызвать эстетические проблемы. Эти проблемы включают в себя:
- Формирование "шкалы" или осадка на трубопроводах и светильниках.
- Щелочной привкус в воде, который может сделать вкус кофе горьким.
- Образование накипи на посуде, стиральной машине, бассейнах.
- Сложность в получении пены из мыла и моющих средств и образование нерастворимых осадков на одежде и т. д.
- Уменьшение эффективности электрических водонагревателей.
Как правило, эти проблемы возникают, когда жесткость варьируется в пределах от 100 до 200 миллиграмм CaCO3/л, что эквивалентно 12 граммам на галлон. Вода может быть смягчена за счет использования ионного обмена или добавлением золы, известково-содовой смеси, но оба процесса увеличивают содержание натрия в воде.
PH питьевой воды

Пристальное внимание к контролю pH необходимо на всех этапах водоподготовки для обеспечения удовлетворительного качества и обеззараживания воды. Хотя pH воды обычно не имеет прямого влияния на потребителей, это один из самых важных эксплуатационных параметров качества воды. Для эффективной дезинфекции с хлором показатель pH предпочтительно должен быть меньше, чем 8. PH воды на входе в систему распределения необходимо контролировать, чтобы свести к минимуму коррозию труб. Невыполнение этого требования может привести к загрязнению питьевой воды и неблагоприятным последствиям для ее вкуса, запаха и внешнего вида.
Оптимальное значение pH будет варьироваться для разных материалов в зависимости от состава воды и природы строительных материалов, используемых в системе распределения, но чаще всего оно лежит в диапазоне 6,5-9,5. Экстремальные значения pH могут быть результатом случайных разливов, поломок на очистных сооружениях.
Идеальный уровень pH ионизированной воды для долгосрочного употребления человеком находится между 8,5 и 9,5 (и никогда не превышает 10,0) с идеальным значением ОВП около 200mV-300mV (и ни в коем случае не выше 400mV).
PH воды в бассейне

Как уже упоминалось выше, pH – важнейшая характеристика не только для питьевой воды, но и для бассейнов, поскольку для дезинфекции воды все еще в основном применяют хлорирование, а при использовании хлора эффективность дезинфекции сильно зависит от исходного значения pH воды.
Хлор является основным дезинфицирующим агентом для предупреждения развития инфекций в общественных бассейнах, но хлор также реагирует с органическими веществами в воде и образует побочные продукты дезинфекции (ППД): органические вещества – производное гуминовых веществ, образующихся в результате взаимодействия воды с потом, мочой, волосами, клетками кожи и остатками средств личной гигиены, попадающих в воду от пловцов. Содержание ППД может быть измерено в виде суммы всех галогенированных соединений. Некоторые ППД увеличивают риск развития астмы, являются канцерогенами или раздражают глаза и кожу.
Хлор является общим названием хлористой кислоты, которая образует газообразный хлор, реагирующий с водой. Растворяясь в воде, кислота образует гипохлорит и имеет значение рКа, равное 7,5.
Хлористая кислота является гораздо более эффективной, чем гипохлорит, убивая бактерии, цисты, споры и неактивные вирусные. Таким образом, если значение pH в плавательном бассейне находится на нижнем уровне регулируемого диапазона, меньшее количество хлора необходимо получить для той же степени дезинфекции, а следовательно, в воде образуется меньше потенциально опасных ППД. Как показывают многочисленные исследования, оптимальный уровень pH воды в бассейне лежит в пределах от 7,5 до 8,0. При снижении pH всего на 1-0,5 единицы (до 7,0-6,5) значительно повышается уровень ППД, которые к тому же еще и геннотоксичны.
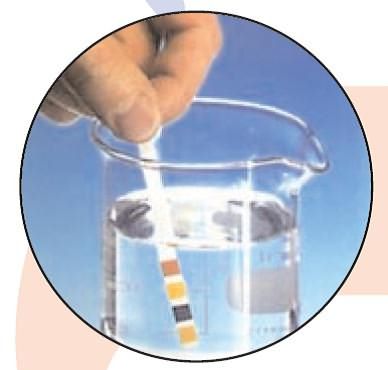
Методы определения pH
Шкала pH является логарифмической шкалой, что означает, что каждое увеличение или уменьшение на 1 единицу представляет собой изменение с коэффициентом 10. Например, раствор с pH 11 в 10 раз более щелочной, чем раствор с pH 10. Существует несколько методов, как определить pH воды.
Определение pH с помощью тест-полосок
Тест-полоски представляют собой лакмусовую бумагу, реагирующую изменением цвета на колебания pH. Приобрести их можно в зоомагазинах, поскольку часто их используют для определения pH воды в аквариумах (даже незначительное колебание этого показателя может привести к гибели рыб).

При контакте с водой цвет тест-полоски изменится. Вам придется только лишь сравнить итоговый цвет с образцом цветовой шкалы на упаковке и получить конкретное значение. Этот метод определения pH быстр, прост, дешев, но имеет достаточно большую погрешность.
Лакмусовая бумага «Роттингер»
Приобрести лакмусовые бумажки в магазинах медтехники вашего города. Проведя анализ различных ph тестов (начиная от дешевых китайских и заканчивая дорогими голландскими), мы пришли к выводу, что минимальную погрешность в показании дают немецкие ph полоски «Роттингер». В упаковке идет индикаторная шкала от 1 до14 (максимальный доступный интервал!) и 80 ph полосок, которых хватает на долгое время. С помощью данных полосок можно измерить не только ph воды, но и ph таких биологических жидкостей, как слюна, моча и тд. Так как хорошие ph метры достаточно дорогие (около 3000руб), и для них приходится покупать буферные растворы для калибровки , то лакмусовая бумага «Роттингер» , цена которой не превышает 250-350 руб., послужит вам незаменимым помощником в точном определении уровня ph.

Определение pH с помощью pH-метра
В пластиковый или стеклянный стаканчик отбирают пробу воды (20-30 мл). Датчик прибора ополаскивают небольшим количеством дистиллированной воды, а затем погружают в раствор вместе с датчиком температуры. Шкала прибора показывает вам точное значение pH исследуемого раствора. При этом следует учитывать, что на точность измерений влияет регулярная калибровка прибора, для которой используют стандартные растворы с известной величиной pH. Этот метод определения pH точен, прост, быстр, но требует больших материальных затрат по сравнению с предыдущим и простейших навыков работы с лабораторным оборудование и химическими растворами.
Таким образом, pH воды – это не просто термин из школьного курса химии, но и показатель качества воды, который должен контролироваться во избежание возникновения проблем с оборудованием и здоровьем.
fb.ru
РН это:
РНВодоро́дный показа́тель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
![\mbox{pH} = -\lg \left[ \mbox{H}^+ \right]\!](http://i.zna4enie.ru/6/opredelenie-rn-vody_0.png)
Содержание
|
История
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogenii — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную -lgX, а буква H в данном случае обозначает концентрацию ионов водорода (H+), или, точнее, термодинамическую активность оксоний-ионов.
Уравнения, связывающие pH и pOH
Вывод значения pH
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH-] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH-] говорят, что раствор является кислым, а при [OH-] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH).
![\mbox{pH} = -\lg \left[ \mbox{H}^+ \right]\!](http://i.zna4enie.ru/6/opredelenie-rn-vody_0.png)
pOH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
![\mbox{pOH} = -\lg \left[ \mbox{OH}^- \right]\!](http://i.zna4enie.ru/c/opredelenie-rn-vody_1.png)
как в любом водном растворе при 22 °C [H + ][OH − ] = 1,0×10 − 14, очевидно, что при этой температуре:
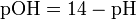
Значения pH в растворах различной кислотности
- Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10-15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Некоторые значения pH Вещество pH
|
Так как при 25 °C (стандартных условиях)[H+] · [OH-] = 10-14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10-7, то pH кислых растворов pH < 7, аналогично pH щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH-); при понижении температуры, напротив, нейтральная pH возрастает.
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
0.001 мол/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3
0.001 мол/Л NaOH при 20 °C имеет pH=11.73, при 30 °C pH=10.83
Влияние температуры на значения pH объяснятеся различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
См. также
- Ионное произведение воды
- Электролитическая диссоциация
- Константа диссоциации кислот
- Гидролиз
- Индикаторы
- PH-метр
- Титрование
- Буферные растворы
- Основность
Литература
- Бейтс Р., Определение рН. Теория и практика, пер. 2 изд., Перевод с английского под редакцией акад. Б. П. Никольского и проф. М. М. Шульца. «Химия». Л., 1972
Примечания
Wikimedia Foundation. 2010.
dic.academic.ru
Определение реакции воды (рН)
Реакцию воды определяют погружением в нее красной и синей лакмусовых бумажек, через 5 минут их сравнивают с такими же бумажками, смоченными дистиллированной водой.
Посинение красной бумажки указывает на щелочную реакцию, покраснение синей – на кислоту, при отсутствии изменений окраски бумажек – реакция нейтральная. В нейтральной среде рН=7, в кислой она меньше, в щелочной больше.
Питьевая вода должна иметь слабощелочную или нейтральную реакцию (от 6,5 до 8).
Для точного определения величины рН воды используется колориметрический способ или рН-метры.
Определение азотосодержащих веществ в воде
Важным показателем загрязнения воды являются соли аммиака, азотистой и азотной кислоты (нитраты и нитриты).
Определение аммиака
Реактивы:
-
50% раствор сегнетовой соли (виннокислый калий натрий КNаС4Н4O6• 4Н2Oв дистиллированной воде).
-
Реактив Несслера (двойная соль йодистой ртути и йодистого калия – НgI2• 2KJв растворе КОН).
Ход анализа.
В пробирку наливают 10 мл исследуемой воды, добавляют 0,3 мл раствора сегнетовой соли, затем 0,3 мл реактива Несслера. При наличии в воде аммиака, в пробирке через 10 мин появляется желтое окрашивание различной интенсивности, вследствие образования йодистого меркураммония NH2Hg2JO. По интенсивности окраски жидкости делается приближенное заключение о содержании аммиака в воде в мг/л, пользуясь таблицей 4.
При обильном содержании в воде аммиака в пробирке появляется осадок красно-бурого цвета.
Таблица 4
Приближенное определение аммиака
|
Окрашивание при рассматривании |
Содержание аммиака, мг/л |
|
|
сбоку |
сверху |
|
|
Нет |
Чрезвычайно слабо-желтоватое |
0,08 |
|
Чрезвычайно слабо-желтоватое |
Слабо-желтоватое |
0,2 |
|
Очень слабо-желтоватое |
Желтоватое |
0,4 |
|
Светло-желтоватое |
Желтое |
2,0 |
|
Желтое |
Интенсивно желто-буроватое |
4,0 |
|
Мутновато-резко-желтое |
Бурое, раствор мутный |
8,0 |
|
Интенсивно бурое, раствор мутный |
Бурое, раствор мутный |
20,0 |
Допустимое содержание аммиака в питьевой воде – следы (менее 0,02 мг/л).
Определение нитритов
Реактивы:
Реактив Грисса (смесь альфа-нафтиламина, сульфаниловой и янтарной кислоты в дистиллированной воде).
Ход анализа.
В пробирку наливается 10 мл исследуемой воды, прибавляется 0,5 мл реактива Грисса. Пробирку нагревают в течение 5 мин на водяной бане, при комнатной температуре около 70°С.
Появление розового окрашивания в пробирке указывает на присутствие в воде солей азотистой кислоты. По интенсивности окраски жидкости делается приближенное заключение о содержании нитритов в воде в мг/л, пользуясь таблицей 5.
Таблица 5
Приближенное определение нитритов
|
Окрашивание при рассматривании |
Содержание нитритов, мг/л |
|
|
сбоку |
сверху |
|
|
Нет |
Нет |
Менее 0,001 |
|
Едва заметное розовое |
Чрезвычайно слабо-розовое |
0,002 |
|
Очень слабо-розовое |
Слабо-розовое |
0,004 |
|
Слабо-розовое |
Розовое |
0,02 |
|
Светло-розовое |
Розовое |
0,04 |
|
Розовое |
Сильно-розовое |
0,07 |
|
Сильно-розовое |
Красное |
0,2 |
|
Красное |
Ярко-красное |
0,4 |
Допустимое содержание нитритов в питьевой воде – следы (менее 0,02 мг/л).
StudFiles.ru
Определение химических показателей воды
1. Активная реакция воды (рН)
Активная реакция воды, то есть степень ее кислотности или щелочности, характеризуется количественно концентрацией водородных ионов. Отрицательный логарифм концентрации водородных ионов принято обозначатьрН. Для химической чистой воды при температуре 22 ° СрН7 – нейтральная реакция, при рН< 7 – кислая, прирН> 7 – щелочная.
Для определениярН могут быть использованы два метода: колориметрический и электролитический. Колориметрическое определение используют для бесцветных вод. Этот метод основан на свойствах индикаторов менять свою окраску в зависимости от концентрации водородных ионов.
а)определение рН универсальным индикатором
Для определениярН используют индикаторную бумагу, которая представляет собой обычную фильтровальную бумагу, пропитанную раствором того или иного универсального индикатора. К каждой пачке индикаторной бумаги обычно прилагается цветная шкала, показывающая окраску бумаги при различных pH.
б)электролитический метод определения pH
Этот метод основан на применении электродов, потенциал которых зависит от концентрации ионов водорода в исследуемом растворе. Определение потенциала электрода производят, измеряя электродвижущую силу концентрационной цепи, состоящей из стандартного электрода с постоянным потенциалом и исследуемого с неизвестным потенциалом, зависящим от концентрации водородных ионов в исследуемом растворе.
При изменении pH электролитическим методом применяются pHметры. Для определения pH раствора на приборерН-340 необходимо включить прибор в сеть и прогреть в течение 30 мин. Убрать из-под электродов стаканчик с дистиллированной водой, высушить, промокая их чистой фильтровальной бумагой. После этого можно приступать к измерению pH исследуемого раствора.
Для этого необходимо произвести следующие операции:
1. Погрузить электроды в стаканчик с раствором.
2. По нижней шкале pH-метра замерить приближенное значение pH раствора. Для нахождения точного (до сотых) значения pH нужно переключатель «Пределы измерений» поставить на тот диапазон, в который попадает приближенное значение. Если pH около 7, то поставить переключатель на диапазон 58, затем включить «размах» в среднее положение и снять с точностью до сотых показатель по верхней шкале: к значению «5» прибавить показания по верхней шкале.
Снимать показания pH нужно только тогда, когда становиться стрелка на приборе (обычно стрелка устанавливается в течение 0,5–1 мин, а если раствор концентрированный – в течение 2 минут).
Замерив и записав показания прибора, выключить тумблер «размах» и «Пределы измерения», убрать стаканчик с исследуемой водой, высушить фильтровальной бумагой электроды, как в начале опыта, погрузить их в стаканчик с дистиллированной водой.
2. Общая щелочность воды
Общая щелочность воды обусловлена суммой содержащихся в воде ионов HCO3–, CO32–, OH– и других солей слабых кислот, вступающих в реакцию с сильным. Щелочность, обусловленная присутствием сильных оснований (гидратов), называется гидратной. Щелочность, обусловленная присутствием ионов HCO3–, CO32–, называется бикарбонатной или карбонатной. Для природных вод характерна бикарбонатная щелочность. Щелочность выражается в мг-экв/л. Практически щелочность природных вод соответствует концентрации гидрокарбонатных ионов HCO3–, если в воде отсутствуют карбонаты CO32–.
Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Ионы оттитровывают соляной кислотой в присутствии индикатора фенолфталеина, они обуславливают щелочность воды по фенолфталеину. При этом протекают следующие реакции:
|
|
. |
Ион HCO3– оттитровывают соляной кислотой в присутствии индикатора метилоранжа. При этом происходит реакция
![]() .
.
Если щелочность по фенолфталеину равна нулю, то общая щелочность обусловлена только HCO3– и равна карбонатной жесткости, так как в природных водах ионы HCO3– связаны только с ионами Са2+ и Mg2+.
Ход определения. К 100 мл исследуемой воды, отмеренной цилиндром в коническую колбу, приливают 2–3 капли фенолфталеина. Если окраска не появилась, то в ту же колбу добавляют 2–3 капли метилоранжа и титруют 0,1 н – раствором соляной кислоты до перехода окраски из соломенно-желтой в оранжевую. Если же окраска по ф/ф появилась, то раствор надо оттитровать соляной кислотой 0,1 н до исчезновения окраски и затем уже ввести индикатор метилоранж. Суммарное количество кислоты, пошедшее на титрование и есть общая щелочность воды. Титрование нужно вести на белом фоне. Общую щелочность воды находят по формуле:
![]() мг-экв/л, (1.1)
мг-экв/л, (1.1)
где V – количество кислоты, израсходованной на титрование 1000 мл воды, мл;
N – нормальность раствора кислоты.
StudFiles.ru
Качественное определение рН водных растворов неорганических веществ.
Цель работы: научиться определять рН водных растворов.
Задача: определить среду водных растворов электролитов с помощью кислотно-основных индикаторов.
Реактивы и оборудование: 1) 2н. растворы HCl, NaOH, 2) 0,5н. растворы KNO3, Na2CO3, Al2(SO4)3; 3) индикаторы: метилоранж; фенолфталеин; тимоловый синий; 4) штативы с пробирками; 5) химические стаканы на 50 мл.
Вода, являясь весьма слабым электролитом, в очень малой степени диссоциирует на ионы:
Н2О « Н+ + ОН-
Данный равновесный процесс описывается константой равновесия:
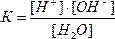 (1)
(1)
где К – константа диссоциации воды. При 220С она равна 1,8 ∙ 10-16.
Так как степень диссоциации воды очень мала, то в уравнении (1) концентрацию воды [Н2О] можно считать величиной постоянной
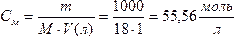 ,
,
тогда [H+]×[OH-] = K [H2O]=Kw, (2)
где Кw – ионное произведение воды.
Подставляя значения К и [Н2О] в уравнение (2), получим численное значение ионного произведения воды при 220С.
Kw = [H+][OH-] = 1,8 ∙ 10-16 ∙ 55,56 = 10-14
Зависимость КW от температуры демонстрируется следующими данными:
t, C0 10 22 30 50 100
КW 0,36 × 10-14 1,00 × 10-14 1,89 × 10-14 5,6 × 10-14 74 × 10-14
Таким образом, КW- величина постоянная лишь при данной температуре.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 220С в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид – ионов остается постоянным.
Отсюда следует, что степень кислотности и степень основности раствора можно выразить с помощью концентраций ионов H+ или OH-:
Нейтральный раствор [H+] = 10-7 моль/л,
Кислый раствор [H+] > 10-7 моль/л,
Щелочной раствор [H+] < 10-7 моль/л.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рH = -lg[H+] или [Н+] = 10-рН (3)
где [Н+] - концентрация ионов водорода, моль/л.
Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксид-ионов, взятый с обратным знаком:
рОН = - lg [OH-] или [ОН-]=10-рОН (4)
где [ОН-] - концентрация гидроксид-ионов, моль/л.
Тогда рН + рОН=14; рОН=14 - рН. (5)
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой
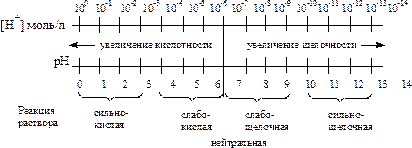
Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+, т.е. выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
Для измерения рН существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода.
Кислотно-основные индикаторы (рН-индикаторы) – органические кислоты и основания, изменение окраски которых зависит от рН среды. (таблица 1).
Таблица 1 Переход окраски индикатора
| № | Индикатор | Интервал рН | Изменение окраски индикатора при возрастании рН |
| Лакмус | 5,0 – 8,0 | Красная ® фиолетовая ® синяя (розовая) | |
| Метилоранж | 3,1 – 4,4 | Красная (розовая) ® оранжево-желтая ® желтая | |
| Тимоловый синий | 1,2 – 2,8 8,0 – 9,6 | Красная ® желтая Желтая ® синяя | |
| Фенолфталеин | 8,0 – 9,6 | Бесцветная ® красная (малиновая) |
Значения рН некоторых наиболее известных растворов с указанием соответствующей им реакции среды: у желудочного сока рН 1,7 (сильнокислая реакция), у торфяной воды рН 4 (слабокислая), у дождевой воды рН 6 (слабокислая), у водопроводной воды рН 7,5 (слабощелочная), у крови рН 7,4 (слабощелочная), у слюны рН 6,9 (слабокислая), у слез рН 7 (нейтральная). Соки некоторых овощей и плодов имеют следующие значения рН:
Огурец 6,92 Щавель 3,74
Морковь «каротель» 6,67 Яблоки сорта
Столовая брюква 6,27 коричное 3,70
Розовый картофель 5,92 кавказский ранет 4,64
Редька.............. 5,32 антоновка 2,50
Качественное определение рН среды водных растворов электролитов выполните в соответствии с таблицей 2 .
Ход работы 1) Для каждой системы приготовить по 3 пробирки (по числу индикаторов).
2) Так как более отчетливо переход окраски индикаторов происходит в разбавленных растворах, поэтому общий объем системы должен составлять » 10-12 капель: 6-8 капель дистиллированной воды плюс 1-2 капли для растворов кислот и щелочей и 4-6 капель для растворов солей.
3) Полученные результаты внесите в таблицу 2, укажите среду этих растворов.
Таблица 2. Определение среды водных растворов электролитов
| № п/п | Электролит | Цвет индикаторов | Среда раствора (слабокислая, сильнокислая, нейтральная, слабощелочная, сильнощелочная) |
| Метил- оранж | Фенол- фталеин | Тимоло- вый синий | |
| Водопроводная вода | |||
| Н2О дистил. | |||
| HCl | |||
| NaOH | |||
| Na2CO3 | |||
| KNO3 | |||
| Al2(SO4)3 |
Литература.
1. Д.А. Князев, С.Н. Смарыгин. Неорганическая химия. – М.: Высшая школа, 2005.
2. Н.Л. Глинка. Общая химия. – М.: Интеграл – Пресс, 2001.
studopedia.ru
Читайте также
![Акт определение Акт определение]() Акт определение
Акт определение- Актив определение
![Бетон определение Бетон определение]() Бетон определение
Бетон определение![Власть определение Власть определение]() Власть определение
Власть определение![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Гражданская война определение Гражданская война определение]() Гражданская война определение
Гражданская война определение![Гражданское право определение Гражданское право определение]() Гражданское право определение
Гражданское право определение![Дайте определение понятию авария Дайте определение понятию авария]() Дайте определение понятию авария
Дайте определение понятию авария![Генетическое определение пола кратко Генетическое определение пола кратко]() Генетическое определение пола кратко
Генетическое определение пола кратко![Генетические механизмы определения пола Генетические механизмы определения пола]() Генетические механизмы определения пола
Генетические механизмы определения пола- Выберите один из вариантов определения истины это
![База данных определение База данных определение]() База данных определение
База данных определение
 Акт определение
Акт определение Бетон определение
Бетон определение Власть определение
Власть определение Болезнь определение
Болезнь определение Гражданская война определение
Гражданская война определение Гражданское право определение
Гражданское право определение Дайте определение понятию авария
Дайте определение понятию авария Генетическое определение пола кратко
Генетическое определение пола кратко Генетические механизмы определения пола
Генетические механизмы определения пола База данных определение
База данных определение