Титрование по Карлу Фишеру
 Титрование по Фишеру
Титрование по Фишеру
Титрование по Карлу Фишеру — классический метод титрования в аналитической химии, используемый для определения малого количества воды в анализируемой пробе. Метод был разработан в 1935 году немецким химиком Карлом Фишером.
В настоящее время используются два варианта метода: кулонометрический и потенциометрический (объемный).
Кулонометрический метод
Основная часть ячейки титрования заполнена анодным раствором, в который помещается проба анализируемого вещества. Анодный раствор (реактив Фишера) состоит из спирта (ROH), основания (B), оксида серы (SO2) и йода (I2) . В качестве спирта обычно используют метанол или монометиловый эфир диэтиленгликоля, а в качестве основания — имидазол или пиридин.
Ячейка титрования также включает в себя катодную часть с катодным раствором (меньшего объёма), погруженную в анодный раствор. Эти две зоны разделены ион-проницаемой мембраной. Титрование проводится йодом I2, который образуется в растворе на платиновом аноде при прохождении через него электрического тока. В присутствии воды йод окисляет SO2, при этом один моль I2 взаимодействует с 1 моль H2O. Другими словами, 2 моль электронов реагируют с 1 моль воды:
B·I2 + B·SO2 + B + H2O → 2BH+I− + BSO3 BSO3 + ROH → BH+ROSO3−Точка эквивалентности, как правило, определяется бипотенциометрическим методом. В анодный раствор погружена пара контрольных платиновых электродов, между которыми пущен постоянный ток. Вблизи точки эквивалентности раствор содержит в основном I− и мало I2. В точке эквивалентности появляется избыток I2, что приводит к резкому падению напряжения между контрольными электродами и служит сигналом окончания титрования.
Суммарный заряд, пошедший на выделение йода, пропорционален содержанию воды в образце. Метод используется в основном для точного определения небольших количеств воды.
Объемный метод
Аналогичен кулонометрическому, но в качестве титранта используется анодный раствор (спирт (ROH), основание (B), SO2 и известная добавка I2). Один моль I2 потребляется для каждого моля Н2О. Точка эквивалентности также детектируется бипотенциометрическим методом.
Метод может использоваться в диапазоне содержания воды от 0,001% до 100%.
Преимущества анализа
Популярность титрования по методу Карла Фишера обусловлена в значительной степени рядом практических преимуществ, которые имеет данный метод над другими методами определения влажности, в том числе:
- Высокая точность и воспроизводимость
- Селективность по воде
- Малые количества необходимых образцов
- Легкая пробоподготовка
- Малое время анализа
- Практически неограниченный диапазон измерения (1ppm до 100 %)
- Пригоден для анализа:
- Твердых веществ
- Жидкостей
- Газов
- Независимость от наличия других летучих веществ
- Пригодность для автоматизации
Наиболее важное преимущество метода титрования по Карлу Фишеру над термическими (потеря веса при прокаливании) — его специфичность для воды. Потери при прокаливании показывают суммарное содержание всех летучих компонентов.
Для обоих вариантов анализа разработаны автоматические титраторы.
Некоторые нормативные документы
- ГОСТ Р 54284-2010 Нефти сырые. Определение воды кулонометрическим титрованием по Карлу Фишеру.
- ГОСТ Р 52795-2007 Кофе жареный молотый. Определение массовой доли влаги. Метод Карла Фишера.
- ГОСТ Р 54281-2010 Нефтепродукты, смазочные масла и присадки. Метод определения воды кулонометрическим титрованием по Карлу Фишеру.
- ОФС.1.2.3.0002.15 Определение воды
Ссылки
- Документы по титрованию методом Карла Фишера
- Определение воды по Карлу Фишеру
- форма выпуска готового реактива Фишера
ru.wikipedia.org
Определение летучих веществ и воды (гф XI) Метод высушивания
Точную навеску вещества помещают в предварительно высушенный и взвешенный бюкс и сушат до постоянной массы (условия высушивания, температура и навеска приводятся в соответствующих частных статьях). Если высушивания проводилось при нагревании, открытый бюкс вместе с крышкой помещают в эксикатор для охлаждения на 50 мин, затем закрывают крышкой и взвешивают. Первое взвешивание проводят после сушки в течение 2 ч (если в частной статье не указано иное время). Последующие взвешивания проводят после каждого часа дальнейшего высушивания.
Определение воды
Определение проводят в приборе (ГОСТ 1594—69), состоящем из стеклянной круглодонной колбы вместимостью от 250 до 500 мл, приемника, представляющего собой градуированную пробирку вместимостью 10 мл, и холодильника. В колбу отвешивают указанное в статье количество вещества (от 10 до 20 г), прибавляют 100 мл толуола (ГОСТ 5789—78) или ксилола, несколько кусочков пемзы или пористой пластинки. Колбу нагревают на электроплитке или песчаной бане до кипения. Кипячение ведут так, чтобы конденсирующийся растворитель не скапливался в холодильнике, а спокойно стекал навстречу поднимающимся парам жидкости со скоростью от 2 до 4 капель в секунду. Кипячение прекращают, когда объем воды в приемнике перестанет увеличиваться и верхний слой растворителя в приемнике станет прозрачным. Вся отогнанная вода должна собираться в нижней части приемника. После охлаждения жидкости в приемнике до комнатной температуры отмечают объем отогнанной воды.
Метод титрования реактивом к. Фишера
Реактив К. Фишера представляет собой раствор двуокиси серы, йода и пиридина в метиловом спирте. Взаимодействие этого реактива с водой протекает в две стадии стехиометрически по уравнениям:
I2 + so2 + н20 + 3c5h5n →2c5h5n · hi + c5h5nso3
C5H5NS03+CH3OH→C5H5N· НS04СН3
С помощью реактива К. Фишера можно точно и быстро определять любые количества воды как в органических, так и неорганических соединениях, в различных растворителях и летучих веществах.
С помощью реактива К. Фишера может быть определена как гигроскопическая, так и кристаллизационная вода.
Реактивы и растворы, применяемые в данном методе, очень гигроскопичны, поэтому должны быть приняты меры предохранения их от атмосферной влаги.
Для титрования применяют прибор, который представляет собой закрытую систему, состоящую из бюретки, защищенной осушительной
трубкой (хлорид кальция по ГОСТу 4460—77; силикагель — индикатор по ГОСТу 8984—75 и т.п.), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой. Колба должна быть также снабжена осушительной трубкой. Титрование проводят при перемешивании, для чего удобно применять магнитную мешалку.
Методика определения. Точную навеску препарата, содержащую приблизительно от 0,03 до 0,05 г воды, помещают в сухую колбу вместимостью 100 мл, в которую предварительно внесено 5 мл метилового спирта. Перемешивают 1 мин и титруют реактивом К. Фишера, прибавляя его при приближении к конечной точке по 0,1—0,05 мл.
Конец титрования может быть определен как визуально по изменению окраски от желтой до красновато-коричневой, так и электрометрическим титрованием «до полного прекращения тока» (см. «Электрометрические методы титрования»). Изменение тока в конечной точке титрования при этом выражено настолько четко, что для ее определения построение графиков не обязательно. При исполнении модифицированной схемы на электроды накладывается разность потенциалов от 0,03 до 0,05 В.
Параллельно титруют 5 мл метилового спирта (контрольный опыт).
Содержание воды в процентах (X) вычисляют по формуле:
![]() ,
,
где а — объем реактива К. Фишера, израсходованный на титрование в основном опыте, в миллилитрах;
б — объем реактива К. Фишера, израсходованный на титрование в контрольном опыте, в миллилитрах;
в — навеска препарата в граммах;
Т — титр реактива К. Фишера.
Приготовление реактива К. Фишера. Имеющийся в продаже реактив К. Фишера (ТУ 6-09-1487—76) состоит из двух отдельных растворов № 1 и 2, которые перед употреблением смешивают в объемном соотношении 1:2,17. Титр полученного реактива около 0,004 г/мл. Разбавленный реактив с титром около 0,001 г/мл готовят, смешивая полученный раствор с метиловым спиртом в соотношении 1:1, и применяют только при электрометрическом определении конечной точки титрования.
Установка титра. Около 0,04 г воды (точная навеска) вносят в сухую колбу вместимостью 100 мл, содержащую 5 мл метилового спирта, и титруют реактивом К. Фишера, прибавляя его в конце титрования по 0,1—0,05 мл.
Параллельно титруют 5 мл метилового спирта.
Титр в граммах на миллилитр (W) реактива К. Фишера вычисляют по формуле:
![]() ,
,
где а — навеска воды в граммах;
б — объем реактива К. Фишера, израсходованный на титрование навески воды в метиловом спирте, в миллилитрах;
в — объем реактива К. Фишера, израсходованный на титрование в контрольном опыте, в миллилитрах.
При установке титра разбавленного реактива берут точную навеску воды около 0,01 г.
Титр реактива устанавливают каждый раз перед употреблением. Реактив К. Фишера хранят в сухом, защищенном от света месте в бутылях, плотно закрытых стеклянной пробкой.
Примечание: 1. При отсутствии готовых растворов № 1 и 2 каждый из них может быть приготовлен следующим образом.
Раствор № 1: в сосуд, содержащий 110 г пиридина (ГОСТ 13647—78 ч.д.а.) и охлаждаемый льдом, пропускают обезвоженный сернистый газ до привеса в 27 г. Срок годности раствора № 1 6 мес.
Раствор № 2: в сосуд из оранжевого стекла (с притертой пробкой) помещают 600 мл (475 г) метилового спирта и 75 г йода (ГОСТ 4159—79), закрывают пробкой, перемешивают и оставляют до полного растворения йода. Срок годности раствора № 2 не ограничен.
2. Пиридин и метиловый спирт, употребляемые в данном методе, не должны содержать воды более 0,1%.
3. При определении воды в твердых веществах, нерастворимых в метиловом спирте, тонко измельченную навеску вещества взбалтывают с метиловым спиртом, после чего титруют реактивом К. Фишера. Некоторые вещества или смеси можно растворять в уксусной кислоте (ГОСТ 61—75), хлороформе (ГОСТ 20015—74), пиридине и других растворителях. Время взбалтывания навески с метиловым спиртом, тот или иной растворитель должны быть указаны в частных статьях.
4. Реактив К. Фишера описанного выше состава неприменим для анализа соединений, реагирующих с одним или несколькими компонентами реактива, как, например, аскорбиновая кислота, меркаптаны, сульфиды, гидрокарбонаты и карбонаты щелочных металлов, окиси и гидраты окисей металлов, альдегиды, кетоны и др.
5. Для определения воды в карбонильных соединениях и сильных кислотах при электрометрическом определении конечной точки можно использовать реактив К. Фишера видоизмененного состава, содержащий вместо метилового спирта N,N-диметилформамид. Готовят и применяют реактив в соответствии с ГОСТом 14870—77.
StudFiles.ru
Определение летучих веществ и воды
Летучие вещества могут попасть в ЛП либо вследствие недостаточной очистки от растворителей и промежуточных продуктов в процессе получения, либо в результате накопления продуктов разложения.
Вода в лекарственных веществах может содержаться в виде капиллярной, абсорбционно-связанной, химически связанной (гидратной и кристаллогидратной) или свободной.
ГФ XI, вып. 1, с. 177 «Определение воды», описывает три метода определения летучих веществ и воды.
-
метод высушивания (применим как для определения воды, так и летучих веществ): по разности в весе вещества до и после высушивания. Первое взвешивание через 2 часа, затем каждый час. Высушивание проводят до постоянного веса в открытом бюксе. Условия указываются в частных ФС.
-
метод дистилляции (перегонки) - (применим только для определения воды): вещество помещается в специальный прибор, к нему добавляют толуол или ксилол (жидкости, не смешивающиеся с водой, и, одновременно, легче ее), проводят отгонку. В градуированном приемнике собирается вода, сверху которой находится органический растворитель (это препятствует испарению воды). Когда объем воды перестает увеличиваться, отгонку прекращают и отмечают объем отогнанной воды.
-
метод титрования реактивом Фишера: это химический метод акваметрии, дает возможность быстро и точно определить любые количества воды в органических и неорганических веществах (как гигроскопической, так и кристаллизационной), в летучих веществах – достоинства метода. Прибор для определения представляет собой замкнутую систему, изолированную от внешней среды – недостаток метода: бюретка, сосуд для подачи реактива, колба для титрования. Реактив Фишера – это раствор диоксида серы, йода и пиридина в метаноле:
SO2 + I2 +  +CH3OH
+CH3OH
Метод основан на свойстве йода взаимодействовать с диоксидом серы только в присутствии воды в две стадии. Продукты реакции (H2S04 и HJ) связывается пиридином, что количественно сдвигает равновесие вправо.
H2O + SO2 + I2 + 3C5H5N 2C5H5N · HI + C5H5NSO3
C5H5NSO3 + CH3OH C5H5N HSO4CH3


Конец титрования определяется
-
либо визуально по переходу окраски раствора (из желтого в красно-коричневый),
-
либо электрометрически «до полного прекращения тока».
Ограничение: нельзя применять метод для определения воды в веществах, реагирующих с компонентами реактива Фишера (аскорбиновая кислота, альдегиды, кетоны и тд).
ГФ XII, вып. 2 ОФС "Определение воды" описывает три метода определения воды:
1. Метод к. Фишера (полумикрометод)
2. Микроопределение воды (кулонометрический метод)
При кулонометрическом титровании необходимый для реакции К. Фишера йод образуется при анодном окислении йодид-иона:
2J− − 2e → j2
Образующийся йод реагирует с присутствующей водой и диоксидом серы в присутствии основания. Йод потребляется до тех пор, пока в среде присутствует вода. Избыток йода указывает на достижение конечной точки титрования. Количество оттитрованной воды пропорционально количеству электричества, пропущенному через ячейку.
1 моль йода соответствует 1 молю воды, а количество электричества 10,71 Кл соответствует 1 мг воды.
Вследствие малого тока титрования кулонометрическое определение применяется для количественного определения микроколичеств воды: от 10 мкг до 10 мг.
StudFiles.ru
Титрование по Карлу Фишеру это:
Титрование по Карлу Фишеру Титрование по Фишеру
Титрование по Фишеру
Титрование по Карлу Фишеру — классический метод титрования в аналитической химии, используемый для определения малого количества воды в анализируемой пробе. Метод был разработан в 1935 году немецким химиком Карлом Фишером.
В настоящее время используются два варианта метода: кулонометрический и потенциометрический (объемный).
Содержание
|
Кулонометрический метод
Основная часть ячейки титрования заполнена анодным раствором, в который помещается проба анализируемого вещества. Анодный раствор (реактив Фишера) состоит из спирта (ROH), основания (B), оксида серы (SO2) и йода (I2) . В качестве спирта обычно используют метанол или монометиловый эфир этиленгликоля, а в качестве основания — имидазол или пиридин.
Ячейка титрования также включает в себя анодную часть с анодным раствором (меньшего объёма), погруженную в анодный раствор. Эти две зоны разделены ион-проницаемой мембраной. Титрование проводится йодом I2, который восстанавливается на платиновом аноде при прохождении через него электрического тока. В присутствии воды йод окисляет SO2, при этом один моль I2 взаимодействует с 1 моль H2O. Другими словами, 2 моль электронов реагируют с 1 моль воды:
B·I2 + B·SO2 + B + H2O → 2BH+I− + BSO3 BSO3 + ROH → BH+ROSO3−Точка эквивалентности, как правило, определяется бипотенциометрическим методом. В анодный раствор погружена пара контрольных платиновых электродов, между которыми пущен постоянный ток. Вблизи точки эквивалентности раствор содержит в основном I− и мало I2. В точке эквивалентности появляется избыток I2, что приводит к резкому падению напряжения между контрольными электродами и служит сигналом окончания титрования.
Суммарный заряд, пошедший на выделение йода, пропорционален содержанию воды в образце.
Объемный метод
Аналогичен кулонометрическому, но в качестве титранта используется анодный раствор (спирт (ROH), основание (B), SO2 и известная добавка I2). Один моль I2 потребляется для каждого моля Н2О. Точка эквивалентности также детектируется бипотенциометрическим методом.
Преимущества анализа
Популярность титрования методу Карла Фишера обусловлено в значительной степени рядом практических преимуществ, которые имеет данный метод над другими методами определения влажности, в том числе:
- Высокая точность и воспроизводимость
- Селективностью по воде
- Малые количества необходимых образцов
- Легкая пробоподготовка
- Малое время анализа
- Практически неограниченный диапазон измерения (1ppm до 100 %)
- Пригоден для анализа:
- Твердых веществ
- Жидкостей
- Газов
- Независимость от наличия других летучих веществ
- Пригодность для автоматизации
Наиболее важное преимущество метода титрования Карла Фишера над термическими (потеря веса при прокаливании) — его специфичность для воды. Потери при прокаливании показывают суммарное содержание всех летучих компонентов.
См. также
- Титрование
- Влажность
- Аналитическая химия
Wikimedia Foundation. 2010.
dic.academic.ru
Читайте также
![Базисно индексный метод определения сметной стоимости Базисно индексный метод определения сметной стоимости]() Базисно индексный метод определения сметной стоимости
Базисно индексный метод определения сметной стоимости![Определение твердости методом бринелля Определение твердости методом бринелля]() Определение твердости методом бринелля
Определение твердости методом бринелля![Методы определения твердости Методы определения твердости]() Методы определения твердости
Методы определения твердости![Методы определения длины корневого канала Методы определения длины корневого канала]() Методы определения длины корневого канала
Методы определения длины корневого канала![Методы определения биологического возраста Методы определения биологического возраста]() Методы определения биологического возраста
Методы определения биологического возраста![Методы определения таможенной стоимости Методы определения таможенной стоимости]() Методы определения таможенной стоимости
Методы определения таможенной стоимости![Методы определения возраста горных пород Методы определения возраста горных пород]() Методы определения возраста горных пород
Методы определения возраста горных пород![Метод обучения это в педагогике определение Метод обучения это в педагогике определение]() Метод обучения это в педагогике определение
Метод обучения это в педагогике определение- Методы определения избыточной численности
![Методы определения цен Методы определения цен]() Методы определения цен
Методы определения цен![Методы определения предполагаемой массы плода Методы определения предполагаемой массы плода]() Методы определения предполагаемой массы плода
Методы определения предполагаемой массы плода![Методы определения основного обмена Методы определения основного обмена]() Методы определения основного обмена
Методы определения основного обмена
 Базисно индексный метод определения сметной стоимости
Базисно индексный метод определения сметной стоимости Определение твердости методом бринелля
Определение твердости методом бринелля Методы определения твердости
Методы определения твердости Методы определения длины корневого канала
Методы определения длины корневого канала Методы определения биологического возраста
Методы определения биологического возраста Методы определения таможенной стоимости
Методы определения таможенной стоимости Методы определения возраста горных пород
Методы определения возраста горных пород Метод обучения это в педагогике определение
Метод обучения это в педагогике определение Методы определения цен
Методы определения цен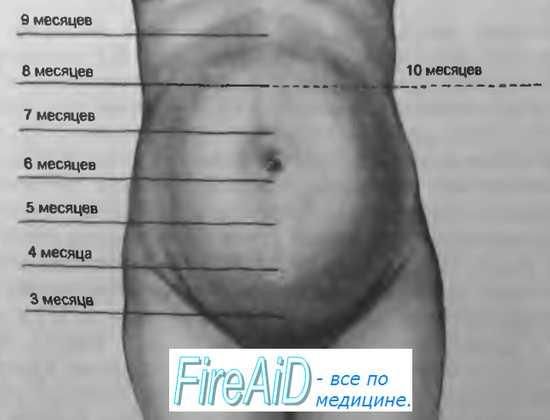 Методы определения предполагаемой массы плода
Методы определения предполагаемой массы плода Методы определения основного обмена
Методы определения основного обмена