Методы определения чувствительности микроорганизмов к антибиотикам
Диско-диффузионный метод
На поверхность плотной питательной среды, засеянной сплошным газоном исследуемой культурой, накладывают не более 6 дисков, пропитанных антибиотиками, на расстоянии не менее 2 см друг от друга. Регистрация результатов проводится через 18-24 часов инкубирования в термостате по диаметру зоны отсутствия роста вокруг дисков с антибиотиками. Наличие роста вокруг диска свидетельствует о нечувствительности данного микроба к антибиотику. Для интерпретации результатов используются специальные таблицы.
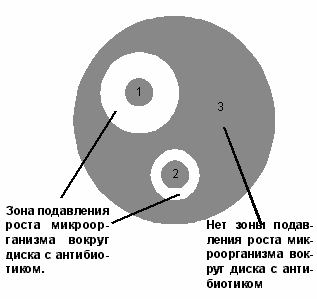
Рисунок 1. Определение чувствительности
микроорганизмов диско-диффузионным методом:
1 – микроорганизм чувствителен к антибиотику;
2 – микроорганизм умеренно резистентен к антибиотику;
3 – микроорганизм устойчив к антибиотику.
Метод Е-тестов
Принцип метода. Определение чувствительности микроорганизма проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).

Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов
Метод серийных разведений в бульонной среде
В пробирках, содержащих 1 мл Мюллер-Хинтон бульона, готовят серийные двукратные разведения антибактериального препарата, например 100 мкг/мл – 1-я, 50 мкг/мл – 2-я, 25 мкг/мл – 3-я, 12,5 мкг/мл – 4-я и т.д. Затем в каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии. Одновременно ставят контроль роста (1 мл Мюллер-Хинтон бульона и 0,1 мл суспензии бактерий). Посевы инкубируют при 37°С в течение 18-24 ч., после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.

Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде
Минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика (в мкг/мл или мг/л), которая in vitro полностью подавляет видимый рост бактерий.
2► Определение чувствительности разных штаммов стафилококков к антибиотикам методом стандартных дисков
|
Антибиотик |
Зона подавления роста, мм |
Характеристика штамма |
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
||
|
5. |
||
|
6. |
Исследуемая культура является чувствительной к __________________________________________________
умеренно устойчивой к _________________________________________________________________________,
устойчивой к _________________________________________________________________________________.
Достоинства метода:____________________________________________________________________________
Недостатки метода:____________________________________________________________________________
3►Определение минимальной подавляющей концентрации (МПК) пенициллина методом серийных разведений.
Вывод: МПК пенициллина для исследуемого штамма составляет _____________________________________
Достоинства метода:____________________________________________________________________________
Недостатки метода:____________________________________________________________________________
4►Выявление и регистрация антагонистического действия разных видов бактерий.
На чашку с МПА штрихом по диаметру засевается микроб-антагонист и перпендикулярно к нему тест-штаммы. Учет результатов проводится через сутки после посева. Наличие и степень антагонистического действия определяют по величине зон задержки роста тест-культур.

Штриховой посев________________________
Вывод: наибольшее антагонистическое действие выявлено к тест-штаммам (укажите виды) _____________________________________________________________________________________________
ЗАНЯТИЕ № 8
ТЕМА: ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ: «ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ МИКРОБИОЛОГИИ, МОРФОЛОГИЯ, ФИЗИОЛОГИЯ И ГЕНЕТИКА МИКРООРГАНИЗМОВ».
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
-
Формы и размеры истинных бактерий. Характеристика шарообразных, палочковидных и извитых форм истинных бактерий.
-
Структура бактерий. Основные отличия прокариотной клетки от эукариот.
-
Клеточная стенка грамположительных и грамотрицательных бактерий.
-
Типы микроскопических препаратов. Техника приготовления фиксированных препаратов.
-
Техника микроскопии в световом микроскопе. Изучение морфологии микроорганизмов в электронном микроскопе.
-
Тинкториальные свойства микробов. Красители. Простые способы окраски фиксированных препаратов.
-
Принципы классификации патогенных прокариот (Берджи, 2001).
-
Защитные приспособления у микроорганизмов. Споры, стадии и условия образования спор, биологическое значение.
-
Капсулы бактерий, их значение.
-
Жгутики, их строение. Реснички. Секс-пили.
-
Сложные способы окраски. Техника окраски по Граму, Цилю-Нельсену, Бурри-Гинсу, Нейссеру.
-
Методы исследования микроорганизмов в живом состоянии. КОН-тест. Принцип метода.
-
Спирохеты. Систематическое положение и морфология спирохет. Особенности ультраструктуры и химического состава. Методы исследования.
-
Актиномицеты, морфология, ультраструктура, химический состав. Патогенные виды. Роль актиномицетов в природе и медицине. Методы выявления.
-
Таксономия хламидий. Морфология, структура, способы выявления. Цикл развития хламидий.
-
Риккетсии, морфология, ультраструктура, химический состав. Патогенные виды.
-
Микоплазмы. Классификация. Филогенез. Способы выявления.
-
Дефектные формы микробов: протопласты, сферопласты, L-формы.
-
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
-
Факторы роста и их источники. Источники минеральных элементов.
-
Способы и механизмы переноса питательных веществ через мембрану.
-
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
-
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
-
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
-
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
-
Принципы и методы культивирования бактерий. Питательные потребности микробов.
-
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
-
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
-
Способы выделения чистых культур аэробных и анаэробных бактерий.
-
Свойства микроорганизмов, используемые для идентификации выделенных культур.
-
Ферменты бактерий, классификация. Способы изучения биохимических свойств микроорганизмов. Практическое использование биохимической активности в идентификации бактерий
-
Определение сахаролитических свойств, состав сред Гисса; определение протеолитических свойств, определение каталазной и оксидазной активности.
-
Принцип работы и особенности применения приборов автоматической идентификации бактериальных культур (гемокультиватор, автоматический анализатор).
-
Особенности культивирования риккетсий и хламидий.
-
Бактериофаги (фаги). История открытия. Морфология, структурные особенности, химический состав и свойства фагов.
-
Вирулентные фаги. Фазы взаимодействия с бактериальной клеткой. Результаты взаимодействия фага и клетки. Умеренные фаги. Профаг. Явление лизогении. Фаговая конверсия.
-
Методы выделения и титрования бактериофагов на плотных и жидких питательных средах.Применение фагов в микробиологии и медицине. Фагодиагностика и фаготипирование.
-
Наследственность. Организация генетического аппарата у бактерий (нуклеоид, плазмиды, Is-последовательности, транспозоны).
-
Принципы функционирования бактериального генома. Организация оперона. Генотип и фенотип.
-
Плазмиды, классификация, структура и свойства плазмид. R-плазмида, особенности структуры и функции. Плазмиды бактериоциногении.
-
Изменчивость микробов. Модификации у бактерий, значение, основные проявления и свойства (ненаследственный характер, адаптивность, высокая частота прямых и обратных изменений, множество индуцирующих факторов).
-
Генотипическая изменчивость. Мутации и их классификация. Мутагены. Фенотипические проявления мутаций. Судьба мутантов. Диссоциация у бактерий. Влияние отбора. Система репарации повреждений генома.
-
Рекомбинационная изменчивость. Механизмы образования комбинированных геномов. Частота изменений отдельных признаков. Трансформация, трансдукция, конъюгация.
-
Практическое значение знаний о генетике микробов. Принципы генетического картирования.
-
Методы генетического анализа (молекулярная гибридизация, полимеразная цепная реакция, блотинг, секвенирование).
-
Понятие о генной инженерии и использование ее методов в микробиологии и биотехнологии. Получение и применение генно-инженерных вакцин и цитокинов.
-
Противомикробные мероприятия. Влияние экологических факторов на микробы. Действие физических факторов (температуры, высушивания, излучений, ультразвука, осмотического давления). Действие химических факторов.
-
Цели, способы, средства и объекты стерилизации и дезинфекции в медицинской и микробиологической практике. Контроль качества дезинфекции. Контроль стерилизации и стерильности. Способы проведения.
-
Антисептика. Определение. Антисептические средства, требования, происхождение, свойства, группы, механизмы действия на микробы. Типы антисептики. Терапевтическая антисептика. Профилактическая антисептика.
-
Химиотерапевтические препараты. Свойства. Основные группы химиопрепаратов. Механизмы действия на бактерии. Понятие об избирательности и "мишенях" действия.
-
Органические и неорганические соединения металлов и металлоидов. Сульфаниламидные препараты. Препараты нитрофуранового ряда. Противогрибковые, противовирусные, противопаразитарные химиопрепараты.
-
Антибиотики. Определение. Продуценты антибиотиков. Синтетические и полусинтетические антибиотики.
-
Основные группы антибиотиков по химической структуре. Бета-лактамные антибиотики Тетрациклины. Аминогликозиды. Макролиды и азолиды. Анзамицины (рифампицины). Левомицетин. Фторхинолоновые антибиотики. Линкомицин. Полимиксины. Гликопептиды
-
Классификация антибиотиков про механизму действия на бактериальную клетку.
-
Механизмы устойчивости микроорганизмов к антибактериальным препаратам.
-
Методы определения чувствительности бактерий к антибиотикам и другим химиопрепаратам. Техника постановки, учета и оценки чувствительности методом дисков, Е-теста, серийных разведений.
ЗАНЯТИЕ № 9
ТЕМА: ЭКОЛОГИЯ БАКТЕРИЙ. ИНФЕКЦИЯ. ПАТОГЕННЫЕ МИКРООРГАНИЗМЫ. ТОКСИНЫ МИКРОБОВ. БИОЛОГИЧЕСКИЙ (ЭКСПЕРИМЕНТАЛЬНЫЙ) МЕТОД.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
-
Основные понятия экологической микробиологии (популяция, биотоп, микробиоценоз, экосистема, биосфера). Экологические связи микробов (симбиоз, комменсализм, нейтрализм, конкуренция, паразитизм, хищничество).
-
Микрофлора тела человека. Нормальная (резидентная) микрофлора человека. Аутохтонная и аллохтонная, пристеночная и просветная микрофлора. Формирование и развитие нормальной микрофлоры. Функции нормальной микрофлоры: противоинфекционная, метаболическая, иммунобиологическая, антитоксическая.
-
Дисмикробиоценоз (дисбактериоз), причины, виды, принципы коррекции.
-
Понятие об инфекции. Определение, общая характеристика. Отличия инфекционных болезней от неинфекционных.
-
Роль микроорганизма в инфекционном процессе. Инфицирующая доза. Способы заражения. Входные ворота. Патогенность и вирулентность. Генетический контроль патогенности и вирулентности. Факторы, повышающие и снижающие вирулентность микробов.
-
Факторы патогенности. Методы определения вирулентности, единицы. Облигатно-патогенные и условно-патогенные микроорганизмы.
-
Токсичность и токсигенность микроорганизмов. Эндотоксины, свойства, получение, применение. Экзотоксины, свойства, получение, единицы измерения. Типы экзотоксинов, механизм действия.
-
Роль макроорганизма в развитии и течении инфекционных болезней. Наследственные факторы. Анатомо-физиологическое состояние организма. Роль условий жизни в развитии и течении инфекционных болезней. Природные факторы. Социальные факторы.
-
Классификация инфекционных процессов по тяжести, характеру возбудителя, по источнику инфекции, способу передачи возбудителя и механизму заражения, по распространенности. Классификация инфекционных процессов по локализации микробного очага, длительности течения и кратности заражения.
-
Динамика инфекционного процесса, его особенности.
-
Биологический (экспериментальный) метод исследования, этапы, оценка. Лабораторные животные. Способы заражения.
ЛАБОРАТОРНАЯ РАБОТА
1► Изучения нормальной микрофлоры.
А) Посев для изучения нормальной микрофлоры кожи рук на среду Эндо и кровяной агар методом реплик.
Принцип метода: стерильные кусочки фильтровальной бумаги 1х1 см в чашке Петри увлажнить стерильным физ. раствором. Стерильным пинцетом поместить кусочек бумаги на исследуемую поверхность кожи рук на 0,5 мин. Поместить бумагу на поверхность плотной питательной среды (отпечаток) на 1 мин. Бумагу удалить. Чашки с отпечатками инкубировать при 370С, 24-48 часов.
В) Провести учет посева микрофлоры, приготовить препараты из разных типов колоний, окрасить по Граму, микроскопировать (в демонстрационных посевах).
Учет посева микрофлоры:
|
биотоп |
|
|
количество и характер колоний на кровяном агаре |
|
|
количество и характер колоний на среде Эндо |
Микроскопия препаратов:
|
Препарат______________ _______________________ Окраска_______________ _______________________ |
|
Препарат______________ _______________________ Окраска_______________ _______________________ |
|
2► Оценка адгезивности E.coliпо их способности к адсорбции на поверхности эритроцитов
Принцип метода: К суспензии эритроцитов добавляют испытуемую культуру микроорганизмов. После инкубации готовят мазки, окрашивают и под микроскопом определяют среднее количество бактерий, адсорбировавшихся на одном эритроците.
Эритроциты в данном случае используются в качестве модели клетки восприимчивого микроорганизма.
|
|
Окраска по ______________ Увеличение _____________ 1 - эритроцит 2 - E.coli |
3► Определение ферментов инвазивности у стафилококков
1. Плазмокоагулаза
Принцип метода: В пробирку, содержащую цитратную плазму крови кролика, вносится испытуемая культура. После инкубации в термостате учитывается результат. При положительном результате плазма свертывается (коагулирует).
|
S. aureus |
Штамм № 1 |
Штамм № 2 |
|
Результат |
2.Фибринолизин
Принцип метода: В пробирку с фибрином (отмытый от эритроцитов сгусток крови) вносят испытуемую культуру. После инкубации в термостате учитывается результат. При положительном результате сгусток растворяется.
|
S. aureus |
Штамм № 1 |
Штамм № 2 |
|
Результат |
3.Гиалуронидаза
Принцип метода: В пробирку с гиалуроновой кислотой (ГУК) вносят испытуемую культуру. После инкубации в термостате добавляют реактив, вызывающий свертывание ГУК и учитывают результат. При положительном результате (вследствие расщепления ГУК) сгустка не образуется.
|
S. aureus |
Штамм № 1 |
Штамм № 2 |
|
Результат |
4.Лецитовителлаза (лецитиназа)
Принцип метода: выделенные культуры стафилококка засевают на желточно-солевой агар, который содержит 7,5% хлорида натрия и желточную суспензию. При положительном результате вокруг колоний вирулентных стафилококков образуется радужный ореол вследствие расщепления лецитина, содержащегося в желтке куриного яйца.
|
S. aureus |
Штамм № 1 |
Штамм № 2 |
|
Результат |
Вывод: (перечислите ферменты вирулентности каждого из двух изученных штаммов) _____________________________________________________________________________________________
_____________________________________________________________________________________________
Бактериальные токсины
Токсичность __________________________________________________________________________________
Токсигенность _________________________________________________________________________________
Эндотоксин ___________________________________________________________________________________
Эндотоксический шок ___________________________________________________________________________
Практическое применение эндотоксинов:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
Экзотоксин ___________________________________________________________________________________
Анатоксин ____________________________________________________________________________________
Схема получения экзотоксина и анатоксина.
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
4.____________________________________________________________________________________________
Практическое применение анатоксинов:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
StudFiles.ru
Методы определения чувствительности бактерий к антибиотикам
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы)обычно применяют:
• Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков). Метод дисков — качественныйи позволяет оценить, чувствителен или устойчив микроб к препарату.
• Методы определенияминимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественныеметоды, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Есть ускоренные способы, с применением автоматических анализаторов.
Определение чувствительности бактерий к антибиотикам методом дисков.Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри.
Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений.Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Определение антибиотика в крови, моче и других жидкостях организма человека.В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом — исследуемой жидкости. Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой. При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина — Е. coli. После инкубирования посевов при 37 °С в течение 18—20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями. Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тест-бактерий. Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1:1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024- 0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл.
Определение способности S. aureus продуцировать бета-лактамазу.В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лактамазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска).
studopedia.ru
Методы изучения антибиотикочувствительности
Критерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя при стандартных условиях постановки опыта. При определении лекарственной устойчивости используют чистую культуру возбудителя, выделенную до начала лечения антибиотиками, т. к. под их воздействием рост микроорганизмов полностью угнетен. Изучение чувствительности проводят методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах.
Метод бумажных дисков
Исследуемую бактериальную культуру засевают газоном на питательный агар в чашке Петри.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посев инкубируют при 37° С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов.
Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность методом серийных разведений.
Метод серийных разведений
Данным методом определяют минимальную концентрацию (МИК) антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащие 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37° С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации антибиотика.
|
Номер пробирки |
Разведение антибиотика |
концентрация антибиотика, мкг/мл |
Исследуемая культура, мл |
рост бактерий (помутнение среды) |
|
1 |
1:100 |
100 |
0,1 |
- |
|
2 |
1:200 |
50 |
0,1 |
- |
|
3 |
1:400 |
25 |
0,1 |
- |
|
4 |
1:800 |
12,5 |
0,1 |
- |
|
5 |
1:1600 |
6,25 |
0,1 |
+ |
|
6 |
1:3200 |
3,12 |
0,1 |
+ |
|
7 |
1 мл бульона без антибиотика |
0,1 |
+ (контроль) |
|
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации создающиеся в сыворотке крови при введении максимальных доз препарата Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
StudFiles.ru
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ МИКРОБОВ К АНТИБИОТИКАМ
Многие бактерии и грибки продуцируют вещества - антибиотики, угнетающие жизнедеятельность микробов других видов, в том числе патогенных. Антибиотики известны против всех возбудителей бактериальных инфекций. Каждый антибиотик имеет свой антимикробный спектр действия. Но чувствительность бактерий к антибиотику может снизиться или даже исчезнуть за счет появления резистентных вариантов у данного вида микробов. Поэтому при возникновении бактериальной инфекции необходимо определить степень чувствительности ее возбудителя к антибиотикам с тем, чтобы подобрать из них наиболее эффективный для целее и лечения и профилактики данной инфекции. Активность антибиотика измеряется в единицах действия (ЕД).
Для определения чувствительности микробов к антибиотикам чаще применяют метод диффузии в агар с использованием дисков, содержащих антибиотики, и метод серийных разведений в жидкой и плотной питательной среде.
Метод диффузии в агар с применением дисков. Он прост в выполнении и позволяет быстро получить результат, что весьма важно для срочного проведения противоэпизоотических мероприятий.
Пробу ставят в чашках с 2%-ным МПА или агаром Хоттингера, содержащим 120-140 мг% аминного азота, или на специальных плотных средах с оптимальным для каждого микроба рН. Среду наливают в чашки по 20 мл следя чтобы слой агара был равномерным и толщиной не менее 4-5 мм. После застывания агара на дно чашек наносят 4-5 точек на равном удалении друг от друга, в 2,5 см от центра и в 2 см от края чашки.
Смыв с каждой испытуемой агаровой культуры доводят до концентрации 10-20 единиц мутности по оптическому стандарту. 1 мл, взвеси вносят в отдельную чашку и покачиванием распределяют по всей поверхности агара остаток отсасывают пипеткой. Чашки с посевами подсушивают при 370С в течение 20-25 мин.
С помощью пинцета диски с одним антибиотиком раскладывают по чашкам в намеченные точки и слегка прижимают их к среде. Перед раскладыванием дисков с каждым другим антибиотиком конец пинцета протирают спиртом и фламбируют. Посевы с дисками выдерживают 3 ч при, комнатной температуре. За это время диффузия антибиотиков в агар в основном заканчивается. Наибольшие концентрации антибиотиков будут под дисками, а по мере удаления от дисков они уменьшаются. Затем чашки ставят вверх дном в термостат при 370С на 16-18 ч.
Учет результатов. В зависимости от чувствительности микроба вокруг диска образуется большая или меньшая зона задержки роста на фоне сплошного газона культуры. С помощью металлической линейки или полоски миллиметровой бумаги измеряют по дну чашки диаметры зон задержки роста, включая размер дисков. Если зона больше 25 мм, микроб высокочувствителен к данному антибиотику; при размере зоны 15-25 мм микроб чувствителен; если диаметр зоны 11-14 мм, микроб малочувствителен, а при меньшем размере зоны илн полном отсутствие задержки роста микроб устойчив к антибиотику. Рост от дельных колоний испытуемого микроба в пределах зоны свидетельствует о наличии в культуре устойчивых к антибиотику особей.
Стандартные бумажные диски имеют диаметр 5 мм и пропитаны антибиотиками в такой концентрации, которая подавляет рост чувствительных микробов в зоне диаметром 28-32 мм. Хранят диски в плотно закрытых склянках или флаконах в сухом месте при комнатной температуре.
Пригодность новых партий питательных сред и дисков с антибиотиками к постановке пробы проверяют с соответствующими для каждого антибиотика тест микробами.
Необходимо употреблять питательные среды с одинаковым содержанием агар-агара, аминоазота и рН, пользоваться чашками с ровным дном и одинаковой толщиной агара. При нарушении этих условий диаметр зоны может измениться на 6-10 мм. Не следует брать в опыт микробы, дающие скудный или наоборот, обильный и ползучий рост. Срок между посевом культур и наложением дисков не должен превышать 30 мин.
При выявлении устойчивых к антибиотикам культур микробов проводят контрольные исследования методом серийных разведений в соответствии с методическими указаниями по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных.
studopedia.ru
Читайте также
![Определение твердости методом бринелля Определение твердости методом бринелля]() Определение твердости методом бринелля
Определение твердости методом бринелля![Методы определения основного обмена Методы определения основного обмена]() Методы определения основного обмена
Методы определения основного обмена![Базисно индексный метод определения сметной стоимости Базисно индексный метод определения сметной стоимости]() Базисно индексный метод определения сметной стоимости
Базисно индексный метод определения сметной стоимости![Методы определения твердости Методы определения твердости]() Методы определения твердости
Методы определения твердости- Методы определения избыточной численности
![Методы определения длины корневого канала Методы определения длины корневого канала]() Методы определения длины корневого канала
Методы определения длины корневого канала![Методы определения биологического возраста Методы определения биологического возраста]() Методы определения биологического возраста
Методы определения биологического возраста![Методы определения таможенной стоимости Методы определения таможенной стоимости]() Методы определения таможенной стоимости
Методы определения таможенной стоимости![Методы определения возраста горных пород Методы определения возраста горных пород]() Методы определения возраста горных пород
Методы определения возраста горных пород![Метод обучения это в педагогике определение Метод обучения это в педагогике определение]() Метод обучения это в педагогике определение
Метод обучения это в педагогике определение![Методы определения цен Методы определения цен]() Методы определения цен
Методы определения цен![Методы определения себестоимости продукции Методы определения себестоимости продукции]() Методы определения себестоимости продукции
Методы определения себестоимости продукции


 Определение твердости методом бринелля
Определение твердости методом бринелля Методы определения основного обмена
Методы определения основного обмена Базисно индексный метод определения сметной стоимости
Базисно индексный метод определения сметной стоимости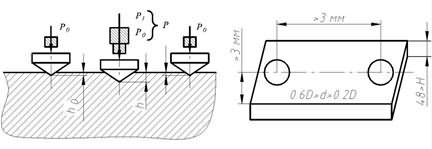 Методы определения твердости
Методы определения твердости Методы определения длины корневого канала
Методы определения длины корневого канала Методы определения биологического возраста
Методы определения биологического возраста Методы определения таможенной стоимости
Методы определения таможенной стоимости Методы определения возраста горных пород
Методы определения возраста горных пород Метод обучения это в педагогике определение
Метод обучения это в педагогике определение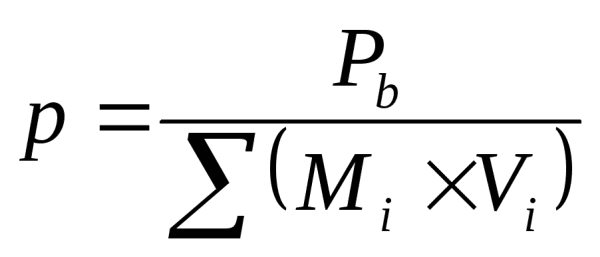 Методы определения цен
Методы определения цен Методы определения себестоимости продукции
Методы определения себестоимости продукции