Основание (химия)
У этого термина существуют и другие значения, см. Основание.Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда![]() ) либо с вакантной орбиталью другого химического соединения (основание Льюиса
) либо с вакантной орбиталью другого химического соединения (основание Льюиса![]() )[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
История
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме[3].
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−[4]. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам[5].
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя[4].
Современное определение
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты[6]. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием[4]:
B + H 2 O ⇌ B H + + O H − . {\displaystyle {\mathsf {B+H_{2}O}}\rightleftharpoons {\mathsf {BH^{+}+OH^{-}}}.}
Основание в теории Льюиса
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса[7]. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями[8]. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях[4].
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания[8][4].
A l C l 3 + C l − ⇌ A l C l 4 − {\displaystyle {\mathsf {AlCl_{3}+Cl^{-}}}\rightleftharpoons {\mathsf {AlCl_{4}^{-}}}}
B F 3 + ( C 2 H 5 ) 2 O ⇌ B F 3 ⋅ ( C 2 H 5 ) 2 O {\displaystyle {\mathsf {BF_{3}+(C_{2}H_{5})_{2}O}}\rightleftharpoons {\mathsf {BF_{3}\cdot (C_{2}H_{5})_{2}O}}}
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью[9][10]. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью[10]. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами[11].
Классификация оснований и кислот в рамках принципа ЖМКО[8][12] Жёсткие основания Промежуточные основания Мягкие основания Жёсткие кислоты Промежуточные кислоты Мягкие кислоты| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. Например, мягкость оснований убывает в следующих рядах[8]:
I − > B r − > C l − > F − , {\displaystyle {\mathsf {I^{-}>Br^{-}>Cl^{-}>F^{-}}},}
C H 3 − > N H 2 − > O H − > F − . {\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-}}}.}
Основание в общей теории Усановича
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители[5]. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции[13].
Сила оснований
Количественное описание силы оснований
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон[8]. Часто константу основности выражают в виде показателя константы основности pKb. Например, для аммиака как основания Брёнстеда можно записать[4][14]:
N H 3 + H 2 O ⇌ N H 4 + + O H − {\displaystyle {\mathsf {NH_{3}+H_{2}O}}\rightleftharpoons {\mathsf {NH_{4}^{+}+OH^{-}}}}
K b = [ N H 4 + ] ⋅ [ O H − ] [ N H 3 ] = 1 , 79 ⋅ 10 − 5 ; {\displaystyle K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{-5};}
p K b = − log K a = 4 , 75. {\displaystyle \ \mathrm {p} K_{b}=-\log K_{a}=4{,}75.}
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
P O 4 3 − + H 2 O ⇌ H P O 4 2 − + O H − ; K b 1 = [ H P O 4 2 − ] ⋅ [ O H − ] [ P O 4 3 − ] = 2 , 10 ⋅ 10 − 2 ; {\displaystyle {\mathsf {PO_{4}^{3-}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{2-}+OH^{-}}};K_{\mathrm {b1} }={\frac {[{\mathsf {HPO_{4}^{2-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {PO_{4}^{3-}}}]}}=2{,}10\cdot 10^{-2};}
H P O 4 2 − + H 2 O ⇌ H 2 P O 4 − + O H − ; K b 2 = [ H 2 P O 4 − ] ⋅ [ O H − ] [ H P O 4 2 − ] = 1 , 58 ⋅ 10 − 7 ; {\displaystyle {\mathsf {HPO_{4}^{2-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{\mathrm {b2} }={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {HPO_{4}^{2-}}}]}}=1{,}58\cdot 10^{-7};}
H 2 P O 4 − + H 2 O ⇌ H 3 P O 4 + O H − ; K b 3 = [ H 3 P O 4 ] ⋅ [ O H − ] [ H 2 P O 4 − ] = 1 , 32 ⋅ 10 − 12 . {\displaystyle {\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{3}PO_{4}+OH^{-}}};K_{\mathrm {b3} }={\frac {[{\mathsf {H_{3}PO_{4}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32\cdot 10^{-12}.}
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов[14] и константе автопротолиза растворителя в общем случае[8].
K a ( N H 4 + ) = [ N H 3 ] ⋅ [ H + ] [ N H 4 + ] = 5 , 62 ⋅ 10 − 10 ; {\displaystyle K_{a}\mathrm {(NH_{4}^{+})} ={\frac {[{\mathsf {NH_{3}}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {NH_{4}^{+}}}]}}=5{,}62\cdot 10^{-10};}
K a ( N H 4 + ) ⋅ K b ( N H 3 ) = K w = 1 ⋅ 10 − 14 ; {\displaystyle {K_{a}\mathrm {(NH_{4}^{+})} }\cdot {K_{b}\mathrm {(NH_{3})} }=K_{w}=1\cdot 10^{-14};}
p K a ( N H 4 + ) + p K b ( N H 3 ) = p K w = 14 {\displaystyle {\mathrm {p} K_{a}\mathrm {(NH_{4}^{+})} }+{\mathrm {p} K_{b}\mathrm {(NH_{3})} }=\mathrm {p} K_{w}=14}
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−[8].
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах[4] Формула основания Формула сопряжённой кислоты pKbpKa(BH+) Формула основания Формула сопряжённой кислоты pKbpKa(BH+)| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Влияние растворителя
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH−, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14[15][16].
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных оснований для них разный[17].
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большинство известных оснований по силе, со своим сопряжённым основанием — ацетат-ионом CH3COO−. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований[18].
Влияние строения основания
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак[19]. Напротив, введение акцепторных заместителей в молекулу понижает силу основания[8].
NH3Метиламин
CH3NH2Этиламин
C2H5NH2Диметиламин
(CH3)2NH Диэтиламин
(C2H5)2NH Триметиламин
(CH3)3N Триэтиламин
(C2H5)3N
| 4,75 | 3,36 | 3,33 | 3,23 | 3,07 | 4,20[К 1] | 3,12[К 1] |
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания соответственно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Данный эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы[20].
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона[20].
C H 3 − > N H 2 − > O H − > F − ; {\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-};}}}
N H 3 > P H 3 > A s H 3 {\displaystyle {\mathsf {NH_{3}>PH_{3}>AsH_{3}}}}
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2- и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной[19].
R C H 2 N H 2 > R C H = N H > R C ≡ N {\displaystyle {\mathsf {RCH_{2}NH_{2}>RCH{=}NH>{RC}{\equiv }{N}}}}
Супероснования
| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
Основания в органической химии
| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
Комментарии
- ↑ 1 2 С одной стороны, наличие третьей алкильной группы в триметиламине и триэтиламине должно увеличивать их основность. С другой стороны, с добавлением третьего заместителя резко уменьшается способность сопряжённых кислот (CH3)3NH+ и (C2H5)3NH+ к гидратации, что уменьшает их устойчивость и суммарно понижает основность аминов.
ru.wikipedia.org
Химическое основание это:
Химическое основаниеОснова́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
- В статье смысл термина основание раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Содержание
|
Способы получения оснований
Получение щелочи при реакции сильноосновного оксида с водойТак как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
Косвенное получение основания (гидроксида) при реакции соли со щелочьюГидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p) Получение щелочи при реакции замещения типичного металла с водой.Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- Растворимые в воде основания (щёлочи)
LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде гидрооксиды
Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания
NH3 × H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
1. Действие на индикаторы: лакмус - синий, метилоранж - жёлтый, фенолфталеин - малиновый,
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
- Кислота
- Соль
- Оксид
Гидроксид
Wikimedia Foundation. 2010.
dic.academic.ru
Основания
Основаниями называют сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими гидроксогруппами (KOH,Ca(OH)2). С позиций теории электролитической диссоциации Аррениуса Основанием называется соединение, диссоциирующее в водном растворе с образованием из отрицательных ионов только гидроксид- ионовOH-. Основания, реагируя с кислотой, образуют только соль и воду. Дальнейшее развитие химической науки уточнило и дополнило определение основания.
NaOH↔ Na+ + OH-, Ca (OH)2↔ Ca2+ + 2OH-
Согласно протонной теории И. Бренстеда, основанием называют вещество, способное принимать протоны. Например, основные свойства аммиака проявляются за счет наличия неопределенной пары электронов атома азота, способной принимать протон. При этом образуется ион аммония по схеме:
H
׀
H−N: +H+→NH4+
׀
Н
Ещё более общее определение дано Г. Льюисом. Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В таблице 4 приведено сопоставление определений оснований.
Таблица 4
Различия в определении кислот и оснований
|
Класс веществ |
Определение кислот и оснований |
||
|
По Аррениусу |
По Бренстеду |
По Льюису |
|
|
Кислоты |
Отдают H+ |
Отдают H+ |
Принимают электронные пары |
|
Основания |
Отдают OH- |
Принимают H+ |
Отдают электронные пары |
Название оснований состоит из слова “гидроксид” – названия гидроксильной группы и названия металла в родительном падеже, из которого образован ион металла с указанием степени окисления: Fe(OH)2– гидроксид железа (II),Fe(OH)3– гидроксид железа (III). В зависимости от числа гидроксогрупп основания подразделяют на однокислотные (KOH,NaOH) и многокислотные (Ba(OH)2,Fe(OH)3).
Гидроксиды делят на две группы: растворимые в воде – щелочи (образованные щелочными и щелочно-земельными металлами) и нерастворимые в воде.
Х и м и ч е с к и е с в о й с т в а
1. Самой типичной реакцией оснований является взаимодействие с кислотами (или реакция нейтрализации). В неё вступают как щелочи, так и нерастворимые основания:
KOH+HBr → KBr + H2O
Zn(OH)2 + H2SO4 = ZnSO4 +2H2O
2. Щелочи взаимодействуют с кислотными оксидами:
Cu (OH)2 +CO2 = CaCO3↓ +H2O
2NaOH + SiO2 = Na2SiO3 + H2O (при нагревании)
3. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
t°C
Cu (OH)2 → CuO +H2O
4. Основания взаимодействуют с солями:
Ca(H2PO4)2 + 2Ca(OH)2 = Ca3(PO4)2↓ + 4H2O
Амфотерные гидроксиды
Амфотерными гидроксидами называют соединения, которые обладают как кислотными, так и основными свойствами.
Свойства амфотерных гидроксидов можно проиллюстрировать следующей схемой:
Гидроксид алюминия
В роли кислоты: H3AlO3→H2O+HAlO2
↓↑
H++AlO2-
В роли основания: Al(OH)3↔Al3++3OH-
В зависимости от того, с более сильными основаниями или с более сильной кислотой взаимодействует гидроксид алюминия, алюминий входит в продукт реакции нейтрализации в виде аниона (AlO2-) или катиона (Al3+)
H3AlO3 + NaOH = HAlO2 + H2O +NaOH = NaAlO2 + 2H2O
Al (OH)3↓ +3HCl = AlCl3 + 3H2O
В щелочной среде алюминий является кислотообразователем, что характерно для неметаллов; в кислой среде алюминий проявляет свойства металла и образует ион алюминия.
Амфотерные свойства проявляют гидроксиды переходных металлов различных групп периодической таблицы:
Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 Cr(OH)3
Основные и кислотные свойства у амфотерных оснований проявляются слабо.
П о л у ч е н и е о с н о в а н и й
Растворимые основания (щелочи) получают электролизом водных растворов хлоридов (в технике):
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
или соответствующих металлов IиIIгрупп периодической таблицы или их оксидов с водой (в лаборатории):
2Na + 2H2O = 2NaOH + H2↑
K2O +H2O = 2KOH
Нерастворимые основания обычно получают реакцией обмена между солями и основаниями:
CuSO4 +2KOH = Cu (OH)2↓ + K2SO4
Реакция идет, так как образуется труднорастворимое основание Cu(OH)2(принцип Бертло-Михайленко).
StudFiles.ru
1. Причины развития неравномерных осадок и просадок основания зданий.
Основания и фундаменты
Осадка здания - это смещение здания, вызванное сжатием грунта в основании под зданием. Это нормальный процесс. Важно, чтобы осадка здания проходила равномерно по всему основанию. Для этого необходимо рассчитать ее еще на стадии проектирования.
Просадка основания - быстрая неравномерная вертикальная деформация, связанная с замачиванием просадочных грунтов (например, лёссов) в основании или с оттаиванием мерзлой толщи грунтов.
Причины развития неравномерной осадки:
1. Выклинивание отдельных слоев грунта в пределах контура здания
2. Линзообразное залегание отдельных видов грунта
3. Неодинаковая мощность слоев грунта, залегающих в основании
4. Неодинаковая плотность грунта или неравномерное распределение в грунте различных включений (торф и др.)
5. Неодинаковые нагрузки на отдельные фундаменты и разные размеры фундаментов при равных контактных давлениях
6. Неодинаковое влияние соседних фундаментов на осадку фундаментов в средних и крайних частях сооружения
7. Неодновременное загружение фундаментов в период постройки сооружения
8. Загружение отдельных фундаментов нагрузкой меньше проектной
Воздействие метеорологических факторов:
9. Промерзание и оттаивание грунта в основании при устройстве фундаментов и строительстве зданий;
10. Набухание и размягчение грунта в оснований при увлажнении его атмосферными водами;
11. Высыхание грунта в основании под воздействием солнечной радиации и ветра.
Воздействие грунтовых вод:
12. разрушение слоев грунта гидростатическим давлением;
13. Разрушение грунта в результате гидродинамического воздействия;
14. Суффозия грунта потоком грунтовых вод в котлован или приямки.
Динамическое воздействие на водонасыщенные, очень пористые пылеватые и глинистые грунты:
15. При перемещении механизмов по дну котлована;
16. При ударах землеройных машин о грунт (например, при разработке прочного или мерзлого грунта);
17. При выполнении взрывных работ около возводимого сооружения.
2. Определение осадки основания методом послойного суммирования.
Сущность метода заключается в определении осадок элементарных слоев основания в пределах сжимаемой толщи от дополнительных вертикальных напряжений σZP, возникающих от нагрузок, передаваемых сооружениям.
Так как в основу этого метода положена расчетная модель основания в виде линейно-деформируемой сплошной среды, то необходимо ограничить среднее давление на основание таким пределом, при котором области возникающих пластических деформаций лишь незначительно нарушают линейную деформируемость основания, т.е. требуется удовлетворить условие:
![]()
Для определения глубины сжимаемой толщи Нс вычисляют напряжения от собственного веса σZq и дополнительные от внешней нагрузки σZP.
Нижняя граница сжимаемой толщи ВС основания принимается на глубине z = Нс от подошвы фундамента, где выполняется условие:
![]()
т.е. дополнительные напряжения составляют 20% от собственного веса грунта.
При наличии нижеуказанной глубины грунтов с модулем деформации Е≤5 МПа должно соблюдаться условие:
![]()
Расчет осадки удобно вести с использованием графических построений в следующей последовательности:
1) строят геологический разрез строительной площадки на месте рассчитываемого фундамента;
2) наносятся размеры фундамента;
3) строятся эпюры напряжений от собственного веса грунта σZg и дополнительного σZP от внешней нагрузки;
4) определяется сжимаемая толща Нс;
5) разбивается Нс на слои толщиной hi≤0,4b;
6) определяется осадка элементарного слоя грунта по формуле:
![]()
Тогда полную осадку можно найти простым суммированием осадок всех элементарных слоев в пределах сжимаемой толщи из выражения:
![]()
где β— безразмерный коэффициент, зависящий от коэффициента относительных поперечных деформаций, принимаемый равным 0,8; hi — высота i-го слоя; Ei — модуль деформации i-го слоя грунта;
![]() —среднее напряжение i-го элементарного слоя.
—среднее напряжение i-го элементарного слоя.
Метод послойного суммирования позволяет определять осадку не только центральной точки подошвы фундамента. С его помощью можно вычислить осадку любой точки в пределах или вне пределов фундамента. Для этого пользуются методом угловых точек и строится эпюра напряжений вертикальной, проходящей через точку, для которой требуется расчет осадки.
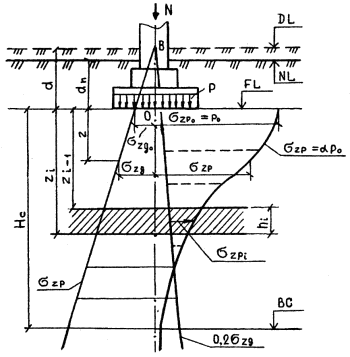
Таким образом, метод послойного суммирования в основном используется при расчете небольших по размерам фундаментов зданий и сооружений и при отсутствии в основании пластов очень плотных малосжимаемых грунтов.
StudFiles.ru
Что такое основание? Основания- это... | химия 8 класс помогите плиз! у меня нету учебника))
Вивианн
Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
Алена конева
Это щелочи!
Основание — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (-OH). Имеются различные определения основания. С точки зрения теории раствора, основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
 Автомобиль определение
Автомобиль определение Акт определение
Акт определение Административное право определение
Административное право определение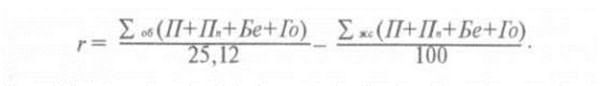 Вес определение
Вес определение Аренда определение
Аренда определение Бетон определение
Бетон определение Брак это определение в производстве
Брак это определение в производстве Вина определение
Вина определение Власть определение
Власть определение Восприятие определение
Восприятие определение