Степень окисления
Не следует путать с формальным зарядом по Льюису. См. также: Список степеней окисления элементовСте́пень окисле́ния (окислительное число[1]) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле (см. #Условность).
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Определение
Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов). В случае ковалентной связи между одинаковыми атомами электроны делят поровну между атомами.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
A l 3 + + 3 e − → A l {\displaystyle {\mathsf {Al^{3+}+3e^{-}\rightarrow Al}}} S 2 − → S + 2 e − {\displaystyle {\mathsf {S^{2-}\rightarrow S+2e^{-}}}}Описание
Степень окисления указывается сверху над символом элемента: N a + 1 C l − 1 , M g + 2 C l − 1 2 , N − 3 H + 1 3 , C + 2 O − 2 , C + 4 O − 2 2 , C l + 1 F − 1 , H + 1 N + 5 O − 2 3 , C − 4 H + 1 4 , K + 1 M n + 7 O − 2 4 . {\displaystyle \mathrm {{\stackrel {+1}{Na}}{\stackrel {-1}{Cl}},{\stackrel {+2}{Mg}}{\stackrel {-1}{Cl}}_{2},{\stackrel {-3}{N}}{\stackrel {+1}{H}}_{3},{\stackrel {+2}{C}}{\stackrel {-2}{O}},{\stackrel {+4}{C}}{\stackrel {-2}{O}}_{2},{\stackrel {+1}{Cl}}{\stackrel {-1}{F}},{\stackrel {+1}{H}}{\stackrel {+5}{N}}{\stackrel {-2}{O}}_{3},{\stackrel {-4}{C}}{\stackrel {+1}{H}}_{4},{\stackrel {+1}{K}}{\stackrel {+7}{Mn}}{\stackrel {-2}{O}}_{4}.} } . В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот[2] (при этом в формулах почти всегда указывается заряд атома/иона, а в тексте — степень окисления +2, +3…, отсюда и путаница; в формулах степень окисления пишут над элементом (знак впереди — на первом месте), заряд для ионов (не для каждого элемента в сложных ионах!) — пишется верхним индексом — сверху справа после иона (знак позади числа): ( N − 3 H + 1 4 ) 2 S + 6 O − 2 4 {\displaystyle ({\stackrel {-3}{\mbox{N}}}{\stackrel {+1}{\mbox{H}}}_{4})_{2}{\stackrel {+6}{\mbox{S}}}{\stackrel {-2}{\mbox{O}}}_{4}} — степени окисления, ( NH 4 1 + ) 2 SO 4 2 − {\displaystyle {({\mbox{NH}}}_{4}^{1+})_{2}{\mbox{SO}}_{4}^{2-}} — заряды.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху: K r 0 , Na + 1 2 O − 2 . {\displaystyle \mathrm {{\stackrel {0}{Kr}},{\stackrel {+1}{\mbox{Na}}}_{2}{\stackrel {-2}{\mbox{O}}}.} }
Правила вычисления степени окисления:
- Степень окисления атома любого элемента в свободном (несвязанном) состоянии (простое вещество) равна нулю, так, например, атомы в молекулах имеют нулевую степень окисления: O 0 3 , O 0 2 , H 0 2 , N 0 2 , S 0 8 , P 0 4 , B r 0 2 , C l 0 2 , C 0 , F e 0 , N a 0 . {\displaystyle \mathrm {{\stackrel {0}{O}}_{3},{\stackrel {0}{O}}_{2},{\stackrel {0}{H}}_{2},{\stackrel {0}{N}}_{2},{\stackrel {0}{S}}_{8},{\stackrel {0}{P}}_{4},{\stackrel {0}{Br}}_{2},{\stackrel {0}{Cl}}_{2},{\stackrel {0}{C}},{\stackrel {0}{Fe}},{\stackrel {0}{Na}}.} }
- Степень окисления любого простого одноатомного иона соответствует его заряду, например: Na+ = +1, Ca2+ = +2, Cl− = −1.
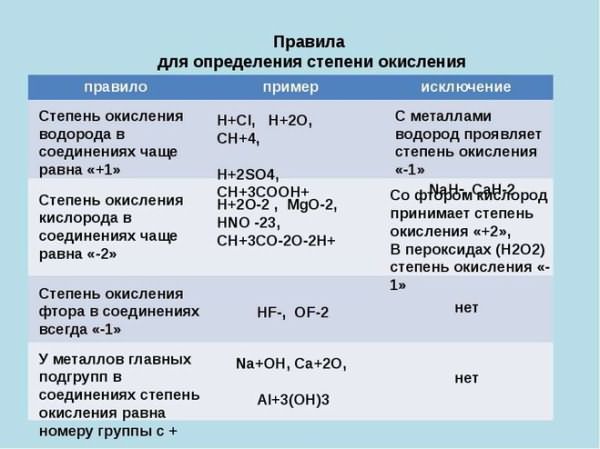
- Степень окисления водорода в любом неионном соединении равна +1. Это правило применимо к подавляющему большинству соединений водорода, таких, как H2O, NH3 или CH4. (Определение через электротрицательность даёт исключение для некоторых веществ: S i + 4 H − 1 4 , A s + 3 H − 1 3 {\displaystyle \mathrm {{\stackrel {+4}{Si}}{\stackrel {-1}{H}}_{4},{\stackrel {+3}{As}}{\stackrel {-1}{H}}_{3}} } ). Для ионных гидридов металлов, например NaH, степень окисления водорода −1.
- Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода равна −2 в H2O, H2SO4, NO, CO2 и CH3OH; но в пероксиде водорода, H2O2 (HO—OH), она равна −1 (другими исключениями из правила, согласно которому кислород имеет степень окисления −2, являются O + 2 F − 1 2 , O + 1 2 F − 1 2 {\displaystyle \mathrm {{\stackrel {+2}{O}}{\stackrel {-1}{F}}_{2},{\stackrel {+1}{O}}_{2}{\stackrel {-1}{F}}_{2}} } , а также свободные радикалы, например ∙ O − 1 H + 1 {\displaystyle \mathrm {\bullet {\stackrel {-1}{O}}{\stackrel {+1}{H}}} } ).
- В соединениях неметаллов, не включающих водород и кислород, неметалл с большей электроотрицательностью считается отрицательно заряжённым. Степень окисления такого неметалла полагается равной заряду его наиболее распространённого отрицательного иона. Например, в CCl4 степень окисления хлора −1, а углерода +4. В CH4 степень окисления водорода +1, а углерода −4. В SF6 степень окисления фтора −1, а серы +6, но в CS2 степень окисления серы −2, а степень окисления углерода +4.
- Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю:
H + 1 2 S + 6 O − 2 4 , {\displaystyle {\stackrel {+1}{\mbox{H}}}_{2}{\stackrel {+6}{\mbox{S}}}{\stackrel {-2}{\mbox{O}}}_{4},} ( + 1 ⋅ 2 ) + ( + 6 ⋅ 1 ) + ( − 2 ⋅ 4 ) = + 2 + 6 − 8 = 0 {\displaystyle (+1\cdot 2)+(+6\cdot 1)+(-2\cdot 4)=+2+6-8=0}
- Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду (см. также выше 2-й пункт). Так, в ионе NH4+ степень окисления N должна быть равной −3 и, следовательно, −3 + 4 = +1. Поскольку в ионе SO42− сумма степеней окисления четырёх атомов кислорода равна −8, сера должна иметь степень окисления, равную +6, чтобы полный заряд иона оказался равным −2.
- В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов. Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановительные процессы должны точно компенсировать друг друга.
- Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе (классического короткого варианта таблицы). Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь (например, для халькогена S положительная степень окисления +6, макс. отрицательная 6 − 8 = −2).
Исключение составляют фтор, кислород, благородные газы (кроме ксенона), а также железо, кобальт, родий и элементы подгруппы никеля: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. Иридий имеет высшую степень окисления +9[3]. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе. У лантаноидов степени окисления не превышают +4; у актиноидов зафиксированы степени окисления вплоть до +8[4].
Правило о равенстве числу восемь суммы абсолютных величин степеней окисления элемента (R) по кислороду (RO) и по водороду (HR; то есть положительных и отрицательных степеней окисления) соблюдается лишь для p-элементов IV—V — VI—VII групп таблицы ПСХЭ. - Элементы-металлы в соединениях обычно имеют положительную степень окисления. Однако встречаются соединения, где степень окисления металлов нулевая (нейтральные карбонилы и некоторые другие комплексы) и отрицательная (алкалиды, ауриды, анионные карбонилы, фазы Цинтля)[5][6].
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.).
Условность
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомарного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH4, метилового спирта CH3OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей. Обычно это молекулы с различными электрондефицитными химическими связями и делокализацией электронной плотности. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как ковалентность равна 4, а координационное число — 3. В молекуле озона, имеющей сходное с SO2 строение, атомы кислорода характеризуется нулевой степенью окисления (хотя часто говорят, что центральный атом кислорода имеет степень окисления +4).
Степень окисления в большинстве случаев не отражает также действительный характер и степень электрической поляризации атомов (истинного заряда атомов, определённых экспериментальным путём). Так, и в HCl, и в NaCl степень окисления хлора принимается равной −1, тогда как на самом деле поляризация его атома (относительный эффективный заряд δ−) в этих соединениях различна: δCl(HCl) = −0,17 единицы заряда, δCl(NaCl) = −0,9 единицы заряда (абсолютного заряда электрона); водорода и натрия — соответственно +0,17 и +0,90[7].
А в кристаллах сульфида цинка ZnS заряды атомов цинка и серы равны соответственно +0,86 и −0,86, вместо степеней окисления +2 и −2[8].
На примере хлорида аммония удобно затронуть существующее в современной химии перекрещивание различных понятий. Так, в NH4Cl атом азота имеет степень окисления −3, ковалентность IV, электровалентность (формальный заряд по Льюису) +1 {аммоний-катион имеет заряд также 1+}, и общую валентность (структурную; общее координационное число) 5, а для его эффективного заряда предлагалось значение −0,45[9].
Проблемы
Применение понятия степени окисления проблематично для следующих классов соединений[10]:
- Соединения, содержащие ковалентные связи между атомами близкой электроотрицательности, например: PH3, Cl3N. В этом случае использование различных шкал электроотрицательности даёт различные результаты. В 2014 году ИЮПАК дал рекомендацию пользоваться шкалой электроотрицательности Аллена, поскольку другие шкалы используют понятия валентного состояния атома (что усложняет определение условной величины) или его степени окисления (что создаёт порочный круг)[11].
- Соединения, содержащие делокализованные ковалентные связи и являющиеся промежуточными между резонансными структурами, где степени окисления атомов различны. Например, в молекуле N2O крайний атом азота имеет степень окисления от −1 до 0, средний — от +2 до +3. В случае, когда атомы одного элемента в структуре равноправны, им приписывают среднее из возможных значений степени окисления, которое может быть дробным. Например: O 2 − − 1 / 2 , C − 6 / 5 5 H 5 − + 1 {\displaystyle \mathrm {{\stackrel {-1/2}{{{O}_{2}}^{-}}},{\stackrel {-6/5}{C}}_{5}{\stackrel {+1}{{{H}_{5}}^{-}}}} } . В уравнениях окислительно-восстановительных реакций часто используют средние (в том числе дробные) значения степени окисления даже в том случае, когда атомы неравноправны, например Fe + 8 / 3 3 O − 2 4 {\displaystyle \mathrm {{\stackrel {+8/3}{\mbox{Fe}}}_{3}{\stackrel {-2}{\mbox{O}}}_{4}} } (по строгому определению Fe + 2 Fe + 3 2 O − 2 4 {\displaystyle \mathrm {{\stackrel {+2}{\mbox{Fe}}}{\stackrel {+3}{\mbox{Fe}}}_{2}{\stackrel {-2}{\mbox{O}}}_{4}} } ).
- Соединения, содержащие полностью делокализованные электроны (металлическая связь). Например, дикарбид лантана LaC2 состоит из ионов La3+, C22− и делокализованных электронов. Наличие в соединении ионов C22− позволяет считать степень окисления лантана равной +2; с другой стороны, бо́льшая длина связи C≡C по сравнению с CaC2, объясняемая взаимодействием делокализованных электронов с антисвязывающими орбиталями, позволяет считать степень окисленния углерода равной −3/2. Третья возможность — рассматривать такие соединения как электриды, то есть не приписывать делокализованные электроны ни одному из атомов. В случае, когда все элементы в соединении — металлы (см. Интерметаллиды), их степени окисления обычно считают равными нулю.
Пример составления уравнения окислительно-восстановительной реакции
F e + 8 / 3 3 O 4 + H 0 2 → F e 0 + H + 1 2 O {\displaystyle {\mathsf {{\stackrel {+8/3}{Fe}}_{3}{\stackrel {}{O}}_{4}+{\stackrel {0}{H}}_{2}\rightarrow {\stackrel {0}{Fe}}+{\stackrel {+1}{H}}_{2}{\stackrel {}{O}}}}}Составляем электронные уравнения:
H 2 − 2 e − = 2 H + 4 3 F e ( + 8 / 3 ) _ + 8 e − = 3 F e 1 {\displaystyle {\begin{array}rl{\mathsf {H_{2}-2e^{-}}}&={\mathsf {2H^{+}}}&{\mathsf {4}}\\{\mathsf {{\underline {3Fe^{(+8/3)}}}+8e^{-}}}&={\mathsf {3Fe}}&{\mathsf {1}}\end{array}}}Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
F e 3 O 4 + 4 H 2 = 3 F e + 4 H 2 O {\displaystyle {\mathsf {Fe_{3}O_{4}+4H_{2}=3Fe+4H_{2}O}}}(то есть в электронных реакциях (методе электронного баланса) железо с дробной степенью окисления записывается только с коэффициентом 3).
На самом деле, в растворе нет ионов Fe2+, Fe3+ (и уж тем более Fe+8/3), также как и Cr6+, Mn7+, S6+, а есть ионы CrO42−, MnO4−, SO42−, а равно и малодиссоциированные «электролиты» Fe3O4 (FeO•Fe2O3). Именно поэтому следует отдать предпочтение методу полуреакций (ионно-электронным методам) и применять его при составлении уравнении всех окислительно-восстановительных реакций, протекающих в водных растворах. То есть мы можем воспользоваться готовой реакцией стандартного электродного потенциала:
Fe3O4 + 8H+ + 8e− = 3Fe + 4H2O, E° = −0,085 В.
ru.wikipedia.org
Как определить степень окисления атома химического элемента
Формальный заряд атома в соединениях — вспомогательная величина, обычно ее используют в описаниях свойств элементов в химии. Этот условный электрический заряд и есть степень окисления. Его значение изменяется в результате многих химических процессов. Хотя заряд является формальным, он ярко характеризует свойства и поведение атомов в окислительно-восстановительных реакциях (ОВР).
Окисление и восстановление
В прошлом химики использовали термин «окисление», чтобы описать взаимодействие кислорода с другими элементами. Название реакций произошло от латинского наименования кислорода - Oxygenium. Позже выяснилось, что другие элементы тоже окисляют. В этом случае они восстанавливаются — присоединяют электроны. Каждый атом при образовании молекулы изменяет строение своей валентной электронной оболочки. В этом случае появляется формальный заряд, величина которого зависит от количества условно отданных или принятых электронов. Для характеристики этой величины ранее применяли английский химический термин "oxidation number", который в переводе означает «окислительное число». При его использовании исходят из допущения, что связывающие электроны в молекулах или ионах принадлежат атому, обладающему более высоким значением электроотрицательности (ЭО). Способность удерживать свои электроны и притягивать их от других атомов хорошо выражена у сильных неметаллов (галогенов, кислорода). Противоположными свойствами обладают сильные металлы (натрий, калий, литий, кальций, другие щелочные и щелочноземельные элементы).
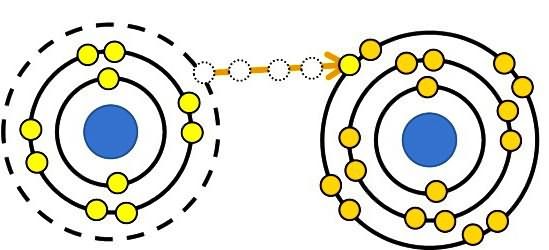
Определение степени окисления
Степенью окисления называют заряд, который атом приобрел бы в том случае, если бы принимающие участие в образовании связи электроны полностью сместились к более электроотрицательному элементу. Есть вещества, не имеющие молекулярного строения (галогениды щелочных металлов и другие соединения). В этих случаях степень окисления совпадает с зарядом иона. Условный или реальный заряд показывает, какой процесс произошел до того, как атомы приобрели свое нынешнее состояние. Положительное значение степени окисления — это общее количество электронов, которые были удалены из атомов. Отрицательное значение степени окисления равно числу приобретенных электронов. По изменению состояния окисления химического элемента судят о том, что происходит с его атомами в ходе реакции (и наоборот). По цвету вещества определяют, какие произошли перемены в состоянии окисления. Соединения хрома, железа и ряда других элементов, в которых они проявляют разную валентность, окрашены неодинаково.
Отрицательное, нулевое и положительное значения степени окисления

Простые вещества образованы химическими элементами с одинаковым значением ЭО. В этом случае связывающие электроны принадлежат всем структурным частицам в равной степени. Следовательно, в простых веществах элементам несвойственно состояние окисления (Н02, О02, С0). Когда атомы принимают электроны или общее облако смещается в их сторону, заряды принято писать со знаком "минус". Например, F–1,О–2, С–4. Отдавая электроны, атомы приобретают реальный или формальный положительный заряд. В оксиде OF2 атом кислорода отдает по одному электрону двум атомам фтора и находится в состоянии окисления О+2. Считают, что в молекуле или многоатомном ионе более электроотрицательные атомы получают все связывающие электроны.
Сера — элемент, проявляющий разные валентность и степени окисления
Химические элементы главных подгрупп зачастую проявляют низшую валентность равную VIII. Например, валентность серы в сероводороде и сульфидах металлов — II. Для элемента характерны промежуточные и высшая валентность в возбужденном состоянии, когда атом отдает один, два, четыре или все шесть электронов и проявляет соответственно валентности I, II, IV, VI. Такие же значения, только со знаком "минус" или "плюс", имеют степени окисления серы:
- в сульфиде фтора отдает один электрон: –1;
- в сероводороде низшее значение: –2;
- в диоксиде промежуточное состояние: +4;
- в триоксиде, серной кислоте и сульфатах: +6.
В своем высшем состоянии окисления сера только принимает электроны, в низшей степени — проявляет сильные восстановительные свойства. Атомы S+4 могут проявлять в соединениях функции восстановителей или окислителей в зависимости от условий.
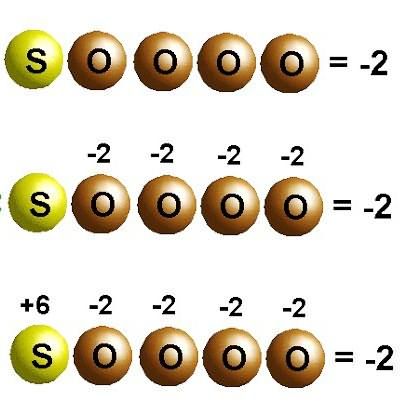
Переход электронов в химических реакциях
При образовании кристалла поваренной соли натрий отдает электроны более электроотрицательному хлору. Степени окисления элементов совпадают с зарядами ионов: Na+1Cl–1. Для молекул, созданных путем обобществления и смещения электронных пар к более электроотрицательному атому, применимы только представления о формальном заряде. Но можно предположить, что все соединения состоят из ионов. Тогда атомы, притягивая электроны, приобретают условный отрицательный заряд, а отдавая, — положительный. В реакциях указывают, какое число электронов смещается. Например, в молекуле диоксида углерода С+4О-22 указанный в верхнем правом углу индекс при химическом символе углерода отображает количество электронов, удаленных из атома. Для кислорода в этом веществе характерно состояние окисления –2. Соответствующий индекс при химическом знаке О — количество добавленных электронов в атоме.
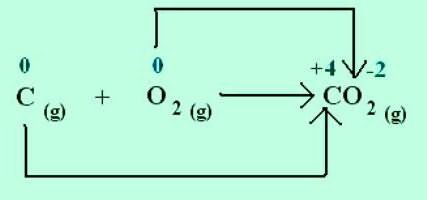
Как подсчитать степени окисления
Подсчет количества отданных и присоединенных атомами электронов может отнять много времени. Облегчают эту задачу следующие правила:
- В простых веществах степени окисления равны нулю.
- Сумма окисления всех атомов или ионов в нейтральном веществе равна нулю.
- В сложном ионе сумма степеней окисления всех элементов должна соответствовать заряду всей частицы.
- Более электроотрицательный атом приобретает отрицательное состояние окисления, которое записывают со знаком "минус".
- Менее электроотрицательные элементы получают положительные степени окисления, их записывают со знаком "плюс".
- Кислород в основном проявляет степень окисления, равную –2.
- Для водорода характерное значение: +1, в гидридах металлов встречается: Н–1.
- Фтор — наиболее электроотрицательный из всех элементов, его состояние окисления всегда равно –4.
- Для большинства металлов окислительные числа и валентности совпадают.
Степень окисления и валентность
Большинство соединений образуются в результате окислительно-восстановительных процессов. Переход или смещение электронов от одних элементов к другим приводит к изменению их состояния окисления и валентности. Зачастую эти величины совпадают. В качестве синонима к термину «степень окисления» можно использовать словосочетание «электрохимическая валентность». Но есть исключения, например, в ионе аммония азот четырехвалентен. Одновременно атом этого элемента находится в состоянии окисления –3. В органических веществах углерод всегда четырехвалентен, но состояния окисления атома С в метане СН4, муравьином спирте СН3ОН и кислоте НСООН имеют другие значения: –4, –2 и +2.
Окислительно-восстановительные реакции

К окислительно-восстановительным относятся многие важнейшие процессы в промышленности, технике, живой и неживой природе: горение, коррозия, брожение, внутриклеточное дыхание, фотосинтез и другие явления.
При составлении уравнений ОВР подбирают коэффициенты, используя метод электронного баланса, в котором оперируют следующими категориями:
- степени окисления;
- восстановитель отдает электроны и окисляется;
- окислитель принимает электроны и восстанавливается;
- число отданных электронов должно быть равно числу присоединенных.
Приобретение электронов атомом приводит к понижению его степени окисления (восстановлению). Утрата атомом одного или нескольких электронов сопровождается повышением окислительного числа элемента в результате реакций. Для ОВР, протекающих между ионами сильных электролитов в водных растворах, чаще используют не электронный баланс, а метод полуреакций.
syl.ru
Понятие о степени окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов.Степень окисления обозначается арабской цифрой, которую ставят перед символом элемента, со знаком «+» или «−», соответствующим отдаче или приобретению электронов. Степень окисления представляет собой всего лишь удобную форму для учета переноса электронов, ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно +0,89 и −0,89, тогда как степени окисления +1 и −1), ни как валентность элемента (например в соединениях CH4, CH3OH, HCOOH, CO2 валентность углерода равна 4, а степени окисления соответственно равны −4, −2, +2, +4).
Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной связью. При определении степени окисления используют следующие правила:
1. Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H2, N2 и т.п.
2. Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например, 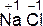 ,
, 

3. Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна −1.
Наиболее распространенная степень окисления кислорода в соединениях –2, за исключением пероксидов (Na2O2, Н2О2 – степень окисления кислорода равна −1) и F2O (степень окисления кислорода равна +2).
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO4, вычисленная исходя из суммарного заряда молекулы [1+x+4(−2)]= 0, х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе SO  равна +6.
равна +6.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У атомов одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства это соединение проявляет.
В качестве примера рассмотрим серу S и ее соединения H2S, SO2 и SO3. Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 7.1.
Таблица 7.1
| Формула вещества | Электронная формула | Окислительно-восстановительные свойства | |
| H2S | 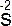 1s22s22p63s23p6 1s22s22p63s23p6 |
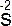 – 2 – 2    ; ; 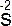 – 6 – 6  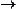 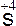 ; ; 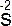 – 8 – 8    восстановитель восстановитель |
|
| S |  1s22s22p63s23p4 1s22s22p63s23p4 |
 + 2 + 2   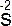 окислитель окислитель |
 – 4 – 4   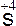 ; ;  – 6 – 6    восстановитель восстановитель |
| SO2 | 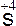 1s22s22p63s23po 1s22s22p63s23po |
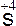 + 4 + 4  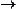  ; ; 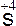 + 6 + 6  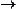 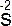 окислитель окислитель |
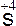 – 2 – 2    восстановитель восстановитель |
| SO3 |  1s22s22p63so3p0 1s22s22p63so3p0 |
 + 2 + 2   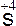 ; ;  + 6 + 6    ; ;  + 8 + 8    окислитель окислитель |
В молекуле H2S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s23p6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
studopedia.ru
Как определить степень окисления?
Как определить степень окисления химического элемента?
Алекс-89
Степень окисления — это численная величина условного электрического заряда, образующегося на том или ином атоме химического элемента.
При определении степени окисления, как правило, предполагают, что общие пары полностью смещены в сторону атома более электроотрицательного элемента. На практике это бывает не всегда, а только в случае соединений с ионной решёткой.
Степень окисления сокращённо называется СО.
Записывается СО в виде числа из арабской цифры или цифр. Данное число пишется над символом соответствующего элемента. Перед числом СО ставится знак: плюс или минус.
Обратите внимание: именно впереди. Если плюс или минус стоИт после цифры — то это ужЕ не СО, а заряд иона.
Основные правила определения степени окисления таковы:
1) Степень окисления элемента в простом веществе равна нулю. Например: N2 (0), O2 (0).
2) Щелочные металлы в соединениях всегда имеют СО +1.
3) Щёлочно-земельные металлы в соединениях имеют СО +2.
4) Алюминий в соединениях почти всегда имеет СО +3.
5) Водород имеет СО, равную +1, при условии, если помимо водорода в рассматриваемом соединении имеется ещё хотя бы один неметалл.
Если же рассматривается соединение водорода с металлом (гидрид), например, NaH или KH, то знайте, что в данном случае у водорода СО равна –1.
6) Кислород в соединениях имеет СО, равную –2, с двумя исключениями:
а) в соединении со фтором OF2 кислород имеет СО, равную +2. Причина состоит в том, что фтор — более электроотрицательный элемент, и он перетягивает на себя электронную пару.
б) в перекисных соединениях (например, H2O2) кислород, как правило, имеет СО, равную –1. Причина состоит в том, что в перекисях имеется связь – O – O –.
7) Сумма СО всех атомов в молекуле равна нулю.
Данное правило позволяет находить СО у элементов, у которых мы её заранее не знаем.
Например, соединение K2SO3.
Согласно правилу номер 2, у калия СО равна +1 (так как калий — это щелочной металл).
Смотрим кислород. У нас не фторид и не перекись. А значит, у кислорода СО равна –2.
Какая же СО у серы?
Составляем уравнение:
(+1)*2 + x + (–2)*4 = 0
2 + x – 8 = 0
x = –2 + 8
x = 6.
Итак, у серы в соединении K2SO4 СО равна 6. Вернее, +6.
Ещё пример.
Соединение HNO3.
Это не гидрид, значит, у водорода СО равна +1 (см. правило номер 5).
У кислорода СО равна –2.
Нужно найти у азота.
Опять же, составляем уравнение:
+1 + x + (–2)*3 = 0
1 + x – 6 = 0
x = –1 + 6
x = 5.
Значит, мы определили, что у азота в азотной кислоте СО равна +5.
И помните, что очень опасно приравнивать валентность к степени окисления!
Например, у азота в HNO3 СО, как мы вычислили, равна +5. Однако валентность равна 4.
Углерод в органических соединениях имеет постоянную валентность 4. Но степень окисления углерода равна: в метане — –4, в этане — –3, а в пропане вообще дробная валентность: минус две целых две третьих. Есть также органические соединения, в которых углерод проявляет положительную СО, например, в муравьиной кислоте (HCOOH) у углерода СО равна +2. А в формальдегиде (HCOH) СО углерода равна нулю.
Nelli4ka
Давайте возьмем за пример формулу оксида фосфора - P2O5.
У кислорода степень окисления постоянна и равна -2.
Далее найдем общее число степени окисления кислорода (или другого известного элемента в случае, если будет дана другая формула): 5 (5 атомов кислорода) умножим на -2, получим -10.
Итак, мы получили общее число отрицательной степени окисления, а, как известно, оно равно другому общему числу, но только уже положительному. Так, общее число положительной степени окисления фосфора в данной формуле равно 10.
Останется только 10 разделить на 2 (два атома фосфора), получится 5. Это значение и будет являться степенью окисления, в нашем случае, фосфора.
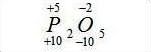
Leona-100
Из школьного курса химии мы знаем, что степень окисления представляет собой численую величину заряда, который образуется на атомах химического элемента.
Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Al3+ + 3e− → Al
S2− → S + 2e− (S2− − 2e− → S)
Чтобы правильно научиться определять степень окисления элемента, рекомендую посмотреть следующие видео:
-Irinka-
В химии термин "окисление" или "восстановление" - это реакция при которых атом (группа атомов) теряют либо приобретают электроны.
Степень окисления – это численная величина, которая характеризует количество перераспределяемых электронов и показывает, каким образом эти электроны распределяются между атомами при реакции.
Определяем степень окисления.
Начитанный даг
Ох уж эта химия, для кого то сложный предмет, а кто то с легкостью изучает и знает даже наизусть все химические элементы из таблицы Менделеева, так вот что касается степени окисления, то как тут уже отметили:
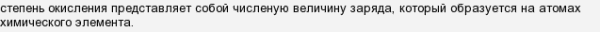
bolshoyvopros.ru
Как находить степень окисления элемента?
Анастасия капуста
Степень окисления у водорода всегда +1, у кислорода всегда -2. Чаще всего степень окисления определяется по номеру группы в котором находиться данный химический элемент. Но есть и исключения, где валентность не совпадает со степенью окисления.
Олег бухало
СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Мы уже знаем о существовании заряженных частиц-ионов. Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента. Записи Na+, Ca2+, Al3+ означают, что атомы данных элементов потеряли соответственно 1, 2, 3 е-, а записи F-, O2-, N3- означают, что атомы данных элементов приобрели соответственно 1, 2, и 3е- .
Степени окисления элементов. Для определения состава молекулярных соединений (SO2, NH3, CO2 и т. д. ) и ионных простых соединений (Na2O, Na2SO4 и т. д.) . При оценке степени окисления элементов соединения представляют расщеплёнными на одноатомные ионы.
Степень окисления-это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, причём знак ставится перед числом: -1, -2, +3, в отличии от заряда иона, где знак ставится после числа.
В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0.
Степени окисления металлов в соединениях всегда положительные, высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключая некоторые элементы: золото Au+3 (I группа) , Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru.
Степени неметаллов могут быть как положительными так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и +, и - ( об этом вы узнаете при изучении ряда электроотрицательностей) . Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое ( число электронов соответствует номеру группы) .
Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
При определении степеней окисления необходимо использовать следующие правила:
1.Элемент в простом веществе имеет нулевую степень окисления;
2.Все металлы имеют положжительную степень окисления;
3.Бор и кремний в соединениях имеют положительные степени окисления;
4.Водород имеет в соединениях степень окисления (+1).Исключая гидриды ( соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H- );
5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F-2 и в перекисях ( Н2О2 - степень окисления кислорода (-1);
6.Фтор имеет степень окисления (-1)
Приведу таблицу, где указаны постоянные степени для наиболее часто используемых элементов: Степени окисления Элементы
+1Li, Na, K, Rb, Cs, Ag, H (кроме гидридов)
+2Be, Mg, Ca, Sr, Zn, Cd, Ba
+3Al, B
-1F,{ Cl, Br, I-если соединены с водородом или металлами}
-2O,{ S, Se, Te-в соединениях с водородом и металлами}
-3{N, P, As}-в соединениях с водородом и металлами
Порядок определения степеней окисления в соединениях. Пример. Определить степени окисления в соединении K2Cr2O 7 .
У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисленя над элементами К+2Cr+62O-27
Степень окисления - Химия
Объясните, пожалуйста очень подробно, как определять
степень окисления химических элементов.
И что такое, группа, подгруппа, побочные группы и т.д. и как определить какие химические элементы к ним относятся.
Помогите, пожалуйста, у меня проблема с этим:(
Надеюсь на помощь.
Nata vanova
Что касается степени окисления.
Следуй этим правилам:
1. Элемент в простом веществе имеет нулевую степень окисления ;
2.Все металлы имеют положжительную степень окисления ;
3.Бор и кремний в соединениях имеют положительные степени окисления ;
4.Водород имеет в соединениях степень окисления (+1).Исключая гидриды ( соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H- );
5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F-2 и в перекисях ( Н2О2 - степень окисления кислорода (-1);
6.Фтор имеет степень окисления (-1)
Постоянные степени для наиболее часто используемых элементов : Степени окисления Элементы
+1Li, Na, K, Rb, Cs, Ag, H (кроме гидридов)
+2Be, Mg, Ca, Sr, Zn, Cd, Ba
+3Al, B
-1F,{ Cl, Br, I-если соединены с водородом или металлами}
-2O,{ S, Se, Te-в соединениях с водородом и металлами}
-3{N, P, As}-в соединениях с водородом и металлами.
Пример. Определить степени окисления в соединении K2Cr2O 7 .
У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число отрицательных степеней равно 12, но атомов 2, значит на один атом приходится (-12):2=(-6), записываем степени окисленя над элементами К+2Cr+62O-27
Анютка дмитриева
степень окисления - условный заряд который приобретает атом... .
Постоянные степени окисления: 1) F только (-1)
2) O2 только (-2)
3) H2 только (+1)
4) металл + № группы гл. подруппа.... поб подгруппа +2
5) простое в-во КНС=0 ст. ок
Сумма степеней окисления в любом соединении равна 0!!!!
Читайте также
- Определение степени
![Определение степени тяжести вреда здоровью при дтп Определение степени тяжести вреда здоровью при дтп]() Определение степени тяжести вреда здоровью при дтп
Определение степени тяжести вреда здоровью при дтп- Определение степени телесных повреждений беларусь
![Электрический ток определение Электрический ток определение]() Электрический ток определение
Электрический ток определение![Административное право определение Административное право определение]() Административное право определение
Административное право определение![Автомобиль определение Автомобиль определение]() Автомобиль определение
Автомобиль определение![3 Закон ньютона определение 3 Закон ньютона определение]() 3 Закон ньютона определение
3 Закон ньютона определение![Вес определение Вес определение]() Вес определение
Вес определение![Анкета определение Анкета определение]() Анкета определение
Анкета определение![База данных определение База данных определение]() База данных определение
База данных определение![Безработица определение Безработица определение]() Безработица определение
Безработица определение![Бетон определение Бетон определение]() Бетон определение
Бетон определение
 Определение степени тяжести вреда здоровью при дтп
Определение степени тяжести вреда здоровью при дтп Электрический ток определение
Электрический ток определение Административное право определение
Административное право определение Автомобиль определение
Автомобиль определение 3 Закон ньютона определение
3 Закон ньютона определение Вес определение
Вес определение Анкета определение
Анкета определение База данных определение
База данных определение Безработица определение
Безработица определение Бетон определение
Бетон определение