Работа, совершаемая газом при различных процессах
Внутренняя энергия газа может изменяться в результате совершения газом работы и сообщения ему теплоты. Поэтому принято говорить о двух формах передачи энергии от одних тел к другим: о теплоте и работе.
Работа газа при произвольном процессе рассчитывается как площадь криволинейной трапеции под графиком p(V). На рис. 6.1 показана произвольная зависимость давления газа p от его объема V (объем газа в начальном состоянии V 1; объем газа в конечном состоянии V 2). Площадь заштрихованной фигуры совпадает с работой, совершенной газом.
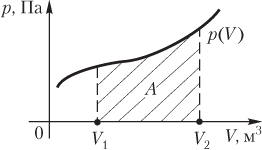
Рис. 6.1
Если зависимость p(V) представляет собой прямую линию, то работа численно равна площади прямолинейной трапеции.
В Международной системе единиц работа, совершаемая газом, измеряется в джоулях (1 Дж).
Работа газа при изобарном процессе (p = const) может быть вычислена по одной из формул:
A = p∆V, или A = νR∆T,
где p — давление газа; ΔV — изменение объема газа при переходе из начального в конечное состояние, ΔV = V 2 − V 1; V 1 — объем газа в начальном состоянии; V 2 — объем газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); ΔT — соответствующее изменение температуры газа, ΔT = T 2 − T 1; T 1 — абсолютная температура начального состояния; T 2 — абсолютная температура конечного состояния.
Работа газа при изохорном процессе (V = const) не совершается:
A = 0.
Работа газа при круговом (циклическом) процессе рассчитывается как площадь фигуры, ограниченной графиком функции p(V). На рис. 6.2 показан график произвольного кругового процесса; цифрами обозначены: 1 — исходное состояние идеального газа (оно совпадает с конечным); 2, 3 — промежуточные состояния газа.
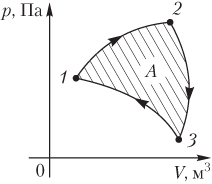
Рис. 6.2
Площадь заштрихованной фигуры совпадает с работой, совершенной газом при циклическом процессе.
Работа, совершаемая газом за цикл, может быть:
· положительной (прямой цикл);
· отрицательной (обратный цикл).
Пример 3. График циклического процесса, происходящего с некоторой массой идеального газа, в координатах p(V) имеет вид прямых, соединяющих точки (0,0250 м3; 75,0 кПа), (0,0750 м3; 125 кПа), (0,0750 м3; 75,0 кПа). Определить абсолютную величину работы, совершаемой газом за цикл.
Решение. На рисунке изображен график циклического процесса в указанных термодинамических координатах p(V).
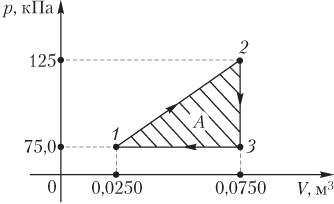
Величина искомой работы равна площади треугольника, ограниченного прямыми, соединяющими указанные точки:
A=12(125−75,0)⋅103⋅(0,0750−0,0250)=1,25⋅103 Дж=1,25 кДж.
Газ за цикл совершает работу 1,25 кДж.
Пример 4. Газ, состоящий из смеси 2,0 г водорода и 4,2 г гелия, при изобарном нагревании совершил работу 46 кДж. Во сколько раз увеличился объем газа, если его начальная температура была равна 300 К? Молярные массы водорода и гелия равны 2,0 и 4,0 г/моль соответственно.
Решение. Запишем формулу для расчета работы смеси газов при изобарном процессе:
A = p∆V = p(V 2 − V 1),
где p — давление смеси газов (постоянная величина), p = const; V 1 — объем смеси газов в начальном состоянии; V 2 — объем смеси газов в конечном состоянии.
Давление смеси газов определяется законом Дальтона:
p = p 1 + p 2,
где p 1 — парциальное давление водорода; p 2 — парциальное давление гелия.
Давления указанных газов в смеси определяются следующими выражениями:
· парциальное давление водорода
p1=m1M1RT1V1,
где m 1 — масса водорода; M 1 — молярная масса водорода; T 1 — температура смеси газов в начальном состоянии; V 1 — объем смеси газов в начальном состоянии; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К);
· парциальное давление гелия
p2=m2M2RT1V1,
где m 2 — масса гелия; M 2 — молярная масса гелия.
Подстановка закона Дальтона и явного вида выражений для парциальных давлений водорода и гелия в формулу для работы, совершаемой смесью указанных газов, дает
A=(p1+p2)(V2−V1)=(m1M1RT1V1+m2M2RT1V1)(V2−V1).
Преобразование данного уравнения к виду
A=(m1M1+m2M2)RT1V1(V2−V1)=(m1M1+m2M2)RT1(V2V1−1)
позволяет выразить искомое отношение объемов
V2V1=A(m1M1+m2M2)RT1+1.
Вычислим:
V2V1=46⋅103(2,0⋅10−32,0⋅10−3+4,2⋅10−34,0⋅10−3)⋅8,31⋅300+1=10.
Следовательно, при совершении указанной работы объем смеси увеличился в 10 раз.
studopedia.ru
§ 52. Работа газа при изменении его объема
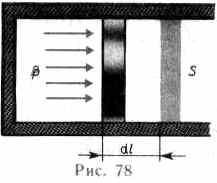
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
A=Fdl=pSdl=pdV,
где S — площадь поршня, Sdl=dV— изменение объема системы. Таким образом,
A=pdV. (52.1)
Полную работу A, совершаемую газом при изменении его объема от V1до V2, найдем
91
интегрированием формулы (52.1):
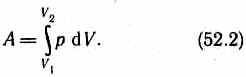
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
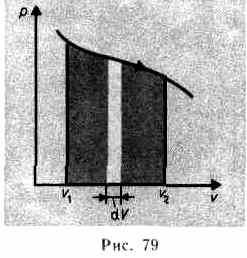
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Например, изменение давления газа при его расширении изобразится кривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием dV на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1до объема V2, определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2.
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
§ 53. Теплоемкость
Удельная теплоемкость вещества величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
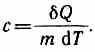
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость— величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:

где v = m/M — количество вещества, выражающее число молей.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с молярной Сm соотношением
Ст= сМ, (53.2)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (51.2) для 1 моля газа с учетом формул (52.1) и (53.1):
CmdT = dUm+ pdVm. (53.3)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
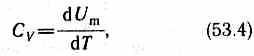
т. е. молярная теплоемкость газа при постоянном объеме Сvравна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Согласно формуле (50.1),

92
тогда
Cv= iR/2. (53.5)
Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде
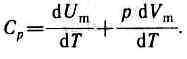
Учитывая, что dUm/dT не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна Сv(см. (53.4)); продифференцировав уравнение Клапейрона — Менделеева pVm=RT (42.4) по T(p=const), получим
Cp= Cv+ R. (53.6)
Выражение (53.6) называется уравнением Майера; оно показывает, что Срвсегда больше Сvна величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Использовав (53.5), выражение (53.6) можно записать в виде
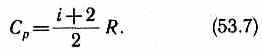
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Срк Cv:
=Cp/Cv=(i+2)/i. (53.8)
Из формул (53.5) и (53.7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
По закону равномерного распределения энергии по степеням свободы (см. § 50), для комнатных температур Cv= 7/2R. Из качественной экспериментальной зависимости молярной теплоемкости Сvводорода (рис. 80) следует, что Cvзависит от температуры: при низкой температуре (50 К) Cv=3/2R, при комнатной — Cv=5/2R (вместо расчетных 7/2R!) и очень высокой — Сv=7/2/R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2 R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени сво-
93
боды) и увеличение при высокой («возбуждаются» колебательные степени свободы).
StudFiles.ru
/ Физика-1, лабораторная работа №3 / Лабораторная работа №3
Федеральное Агентство по образованию
ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ СИСТЕМ УПРАВЛЕНИЯ И РАДИОЭЛЕКТРОНИКИ (ТУСУР)
Кафедра физики
ОТЧЕТ
Лабораторная работа по курсу "Общая физика"
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ КЛЕМАНА–ДЕЗОРМА
Преподаватель Студент группы 3-430-а
Козырев А.В. /____________. / / ____________ /
___________2011 г. 07 октября 2011 г.
2011
1. ЦЕЛЬ РАБОТЫ
Целью данной работы является изучение адиабатического и изохорического процессов в газах, определение отношения теплоемкостей (коэффициента Пуассона) и числа степеней свободы газа.
2. ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКИ ЭКСПЕРИМЕНТА
Величину коэффициента Пуассона можно определить с помощью прибора Клемана и Дезорма, изображенного на рисунке 2.1.
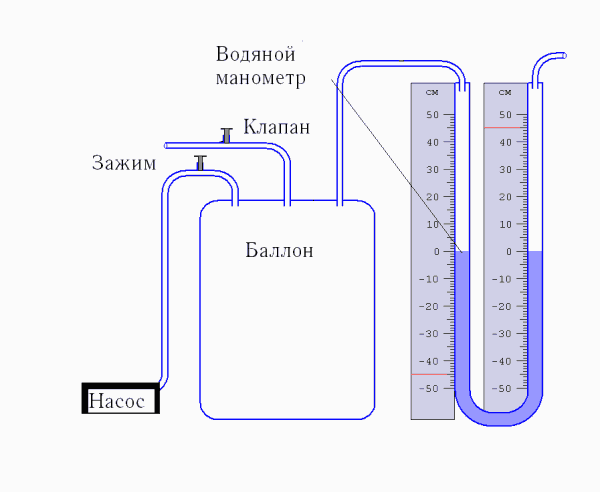
Рисунок 2.1 Схема экспериментальной установки
Для определения отношения теплоемкостей 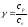 для газа (воздуха), находящегося в баллоне, с ним проводят последовательность термодинамических процессов. Они представлены наP-Vуд – диаграмме на рисунке 2.3. Обозначим через P0, V0, T0 исходные величины термодинамических параметров газа в баллоне. Сначала в баллон накачивается воздух насосом (достаточно быстро,), процесс 1-2. при этом газ в баллоне сжимается и нагревается (выше комнатной температуры). После изохорического остывания до начальной комнатной температуры (процесс 2-3) газ имеет некоторое давление P1 (выше атмосферного) и температуру T0. Затем открывают клапан, соединяя баллон с атмосферой, и газ адиабатически расширяется (процесс 3-4).
для газа (воздуха), находящегося в баллоне, с ним проводят последовательность термодинамических процессов. Они представлены наP-Vуд – диаграмме на рисунке 2.3. Обозначим через P0, V0, T0 исходные величины термодинамических параметров газа в баллоне. Сначала в баллон накачивается воздух насосом (достаточно быстро,), процесс 1-2. при этом газ в баллоне сжимается и нагревается (выше комнатной температуры). После изохорического остывания до начальной комнатной температуры (процесс 2-3) газ имеет некоторое давление P1 (выше атмосферного) и температуру T0. Затем открывают клапан, соединяя баллон с атмосферой, и газ адиабатически расширяется (процесс 3-4).
3. ОСНОВНЫЕ РАСЧЕТНЫЕ ФОРМУЛЫ
Приращение разности давления:
P12 j..n =(P1 j-P2 j), где j-это номер опыта, а n – это количество (3.1)
опытов
Коэффициент Пуассона для каждого измерения:
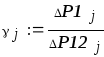
(3.2)
Средний коэффициент значения Пуассона:
 (3.3)
(3.3)
Экспериментальное число степеней свободы газа:
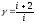 (3.4)
(3.4)
Вычисление погрешностей косвенного измерения γ mean
Абсолютная погрешность вычисления среднего значения коэффициента Пуассона:
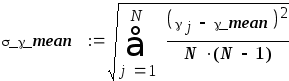
(3.5)
Относительная погрешность вычисления среднего значения коэффициента Пуассона в процентах :
![]()
(3.6)
4. РЕЗУЛЬТАТЫ РАБОТЫ И ИХ АНАЛИЗ.
Таблица 4.1 Результаты прямых и косвенных измерений
|
№ |
P1, мм |
P2, мм |
(P1-P2), мм |
Примечание |
|
|
1 |
583 |
159 |
424 |
1,375 |
|
|
2 |
560 |
166 |
394 |
1,421 |
|
|
3 |
603 |
155 |
448 |
1,346 |
|
|
4 |
588 |
164 |
424 |
1,387 |
|
|
5 |
592 |
157 |
435 |
1,361 |
|
|
6 |
611 |
164 |
447 |
1,367 |
|
|
7 |
601 |
164 |
437 |
1,375 |
Средний коэффициент значения Пуассона вычисляется по формуле (3.3)
γ mean=(1,375+1,421+1,346+1,387+1,361+1,367+1,375)/7=1,376
С помощью преобразованной формулы (3.4) вычисляется экспериментальное число степеней свободы газа
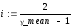
i = 5,319
Вычисление погрешностей косвенного измерения γ mean
Абсолютная погрешность вычисления среднего значения коэффициента Пуассона определяется по формуле (3.5)
σ_γ_mean = 0,009
Относительная погрешность вычисления среднего значения коэффициента Пуассона определяется по формуле (3.6)
ε_ γ_mean = 0.65%
5. ВЫВОДЫ
В ходе данной работы проведены опыты, изучены адиабатический и изохорический процессы в газах. Определено отношение теплоемкостей (коэффициент Пуассона) и число степеней свободы газа. Проверяемые газовые законы подтверждены данными экспериментами.
6. ОТВЕТЫ НА КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какой газ называется идеальным?
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
2. Что такое степени свободы молекул? Как число степеней свободы связано с коэффициентом Пуассона γ?
Числом степеней свободы тела называется число независимых координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве. Так, например, материальная точка, произвольно движущаяся в пространстве, обладает тремя степенями свободы (координаты x, y, z).
Молекулы одноатомного газа можно рассматривать как материальные точки на том основании, что масса такой частицы (атома) сосредоточена в ядре, размеры которого очень малы (10-13см). Поэтому молекула одноатомного газа может иметь лишь три степени свободы поступательного движения.
Молекулы, состоящие из двух, трех и большего числа атомов, не могут быть уподоблены материальным точкам. Молекула двухатомного газа в первом приближении представляет собой два жестко связанных атома, находящихся на некотором расстоянии друг от друга
3. Чему равна теплоемкость идеального газа при адиабатическом процессе?
Теплоемкостью называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы повысить его температуру на один кельвин.
4. В каких единицах измеряются в системе СИ давление, объем, температура, молярные теплоемкости?
Давление – кПа, объем – дм3, температура – в Кельвинах, молярные теплоемкости – Дж/(мольК)
5. Что такое молярные теплоемкости Ср и Сv?
У газа различают теплоемкость при постоянном объеме Сv и теплоемкость при постоянном давлении Ср.
При постоянном объеме работа внешних сил равна нулю, и все сообщаемое газу извне количество теплоты идет целиком на увеличение его внутренней энергии U. Отсюда молярная теплоемкость газа при постоянном объеме Сv численно равна изменению внутренней энергии одного моля газа ∆U при повышении его температуры на 1К:
∆U=i/2*R(T+1)-i/2RT=i/2R
Таким образом, молярная теплоемкость газа при постоянном объеме
Сv=i/2R
удельная теплоемкость при постоянном объеме
Сv=i/2*R/µ
При нагревании газа при постоянном давлении газ расширяется, сообщаемое ему извне количество теплоты идет не только на увеличение его внутренней энергии U, но и на совершение работы A против внешних сил. Следовательно, теплоемкость газа при постоянном давлении больше теплоемкости при постоянном объеме на величину работы A, которую совершает один моль газа при расширении, происходящем в результате повышения его температуры на 1K при постоянном давлении P:
Ср= Сv+A
Можно показать, что для моля газа работа A=R, тогда
Ср= Сv+R=(i+2)/2*R
Пользуясь соотношением между удельными в молярными теплоемкостями, находим для удельной теплоемкости:
Ср= (i+2)/2*R
Непосредственное измерение удельных и молярных теплоемкостей затруднительно, так как теплоемкость газа составит ничтожную долю теплоемкости сосуда, в котором находится газ, и поэтому измерение будет чрезвычайно неточно.
Проще измерить отношение величии Ср/ Сv
γ= Ср/ Сv = (i+2)/i.
Это отношение зависит только от числа степеней свободы молекул, из которых состоит газ.
6. Чем молярная теплоемкость отличается от удельной, удельная – от полной?
Теплоемкостью называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы повысить его температуру на один кельвин.
Удельной теплоемкостью называется физическая величина, численно равная количеству теплоты, которое надо сообщить единице массы этого вещества для увеличения ее температуры на один кельвин.
Кроме того, часто пользуются молярной (мольной) теплоемкостью, которая в отличие от удельной теплоемкости отнесена не к одному килограмму, а к одному молю вещества.
7. Что такое адиабатный процесс?
Адиабатическим называется такой процесс, когда система переходит из одного состояния в другое без теплообмена с внешними по отношению к этой системе телами. Практически адиабатный процесс всегда происходит при достаточно быстром расширении или сжатии газа. Условие адиабатичности будет выполнено, если процесс протекает так быстро, что теплообмен между газом и внешней средой не успевает произойти
8. Что такое уравнение Пуассона?
Коэффициент Пуассона называется также показателем адиабаты, так как он входит в уравнение Пуассона
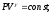
которое характеризует адиабатический процесс, протекающий без теплообмена с окружающей средой Q=0.
9. Может ли случиться, что газ получает теплоту, а его внутренняя энергия уменьшается?
Система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
10. Изменяется ли внутренняя энергия идеального газа при изотермическом процессе?
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q=A
11. Какое влияние на результат опытов может оказать наличие водяного пара в воздухе, которым наполнен баллон?
Не всякий процесс, проведенный в адиабатической оболочке, т. е. без теплообмена с окружающими телами, удовлетворяет этому условию. Примером не квазистатического процесса, в котором промежуточные состояния неравновесные, может служить расширение газа в пустоту. На рис. 3.9.3 изображена жесткая адиабатическая оболочка, состоящая из двух сообщающихся сосудов, разделенных вентилем K. В первоначальном состоянии газ заполняет один из сосудов, а в другом сосуде – вакуум. После открытия вентиля газ расширяется, заполняет оба сосуда, и устанавливается новое равновесное состояние. В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируемая. Из первого закона термодинамики следует: ΔU = 0, т. е. внутренняя энергия газа осталась неизменной. Так как внутренняя энергия идеального газа зависит только от температуры, температуры газа в начальном и конечном состояниях одинаковы – точки на плоскости (p, V), изображающие эти состояния, лежат на одной изотерме. Все промежуточные состояния газа неравновесные и их нельзя изобразить на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
12. Какие из термодинамических параметров, используемых в данной работе, являются функциями состояния?
13. Какие из термодинамических параметров, используемых в данной работе, являются функциями процесса?
14. Как изменяется энтропия при адиабатическом процессе? Ее статистический и термодинамический смысл?
В термодинамике важную роль играет физическая величина, которая называется энтропией. Изменение энтропии в каком-либо квазистатическом процессе равно приведенному теплу ΔQ / T, полученному системой. Поскольку на любом участке адиабатического процесса ΔQ = 0, энтропия в этом процессе остается неизменной.
15. Чему равна теплоемкость при изотермическом процессе?
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CVΔT = ΔU.
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
16. Какие из термодинамических параметров, используемых в данной работе, являются аддитивными?
Если после предельная величина пропорциональна первой степени числа частиц, то её называют аддитивной. Примерами таких величин являются объем, энтропия, внутренняя энергия.
17. Какие из термодинамических параметров, используемых в данной работе, являются не аддитивными?
Если после предельная величина пропорциональна нулевой степени числа частиц, то её называют неаддитивной. Примерами таких величин являются давление, температура, химический потенциал.
18. Что такое обратимые процессы?
Обратимый процесс в термодинамике - процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы, строго говоря, являются необратимыми процессами.
7. ПРИЛОЖЕНИЕ
К работе прилагается регистрационный файл (*.REG).
StudFiles.ru
Механическая работа
Размерность Единицы измерения СИ СГС Примечания| Работа | |
| A = F ⋅ S {\displaystyle A={\mathbf {F}}\cdot {\mathbf {S}}} | |
|
L2MT−2 |
|
|
Дж |
|
|
эрг |
|
|
скалярная величина |
|
| W = F ⋅ S = F ⋅ S ⋅ cos φ {\displaystyle W={\mathbf {F}}\cdot {\mathbf {S}}=F\cdot S\cdot \cos \varphi } | ||||||
| Работа силы | ||||||
| Ключевые статьи | ||||||
Работа в физике
|
||||||
| См. также: Портал:Физика |
Мeханическая работа — это физическая величина — скалярная количественная мера действия силы (равнодействующей сил) на тело или сил на систему тел. Зависит от численной величины и направления силы (сил), и от перемещения тела (системы тел)[1].
Используемые обозначения
Работа обычно обозначается буквой A (от нем. Arbeit — работа, труд) или буквой W (от англ. work — работа, труд).
Определение
Работа силы, приложенной к материальной точке
Суммарная работа по перемещению одной материальной точки, совершаемая несколькими силами, приложенными к этой точке, определяется как работа равнодействующей этих сил (их векторной суммой). Поэтому дальше будем говорить об одной силе, приложенной к материальной точке.
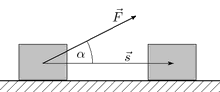
При прямолинейном движении материальной точки и постоянном значении приложенной к ней силы работа (этой силы) равна произведению проекции вектора силы на направление движения и длины вектора перемещения, совершённого точкой:
A = F s s = F s c o s ( F , s ) = F → ⋅ s → {\displaystyle A=F_{s}s=Fs\ \mathrm {cos} (F,s)={\vec {F}}\cdot {\vec {s}}}Здесь точкой обозначено скалярное произведение, s → {\displaystyle {\vec {s}}} — вектор перемещения; подразумевается, что действующая сила F → {\displaystyle {\vec {F}}} постоянна в течение времени, за которое вычисляется работа.
В общем случае, когда сила не постоянна, а движение не прямолинейно, работа вычисляется как криволинейный интеграл второго рода по траектории точки[2]:
A = ∫ F → ⋅ d s → . {\displaystyle A=\int {\vec {F}}\cdot {\vec {ds}}.}(подразумевается суммирование по кривой, которая является пределом ломаной, составленной из последовательных перемещений d s → , {\displaystyle {\vec {ds}},} если вначале считать их конечными, а потом устремить длину каждого к нулю).
Если существует зависимость силы от координат[3], интеграл определяется[4] следующим образом:
A = ∫ r → 0 r → 1 F → ( r → ) ⋅ d r → {\displaystyle A=\int \limits _{{\vec {r}}_{0}}^{{\vec {r}}_{1}}{\vec {F}}\left({\vec {r}}\right)\cdot {\vec {dr}}} ,где r → 0 {\displaystyle {\vec {r}}_{0}} и r → 1 {\displaystyle {\vec {r}}_{1}} — радиус-векторы начального и конечного положения тела соответственно.
- Следствие. Если направление приложенной силы ортогонально перемещению тела, или перемещение равно нулю, то работа (этой силы) равна нулю.
Работа сил, приложенных к системе материальных точек
Работа сил по перемещению системы материальных точек определяется как сумма работ этих сил по перемещению каждой точки (работы, совершённые над каждой точкой системы, суммируются в работу этих сил над системой).
Даже если тело не является системой дискретных точек, его можно разбить (мысленно) на множество бесконечно малых элементов (кусочков), каждый из которых можно считать материальной точкой и вычислить работу в соответствии с определением выше. В этом случае дискретная сумма заменяется на интеграл.
- Эти определения могут быть использованы как для вычисления работы конкретной силы или класса сил, так и для вычисления полной работы, совершаемой всеми силами, действующими на систему.
Кинетическая энергия
Кинетическая энергия вводится в механике в прямой связи с понятием работы.
Схема рассуждений такова: 1) попробуем записать работу, совершаемую всеми силами, действующими на материальную точку и, пользуясь вторым законом Ньютона (позволяющим выразить силу через ускорение), попытаться выразить ответ только через кинематические величины, 2) убедившись, что это удалось, и что этот ответ зависит только от начального и конечного состояния движения, введём новую физическую величину, через которую эта работа будет просто выражаться (это и будет кинетическая энергия).
Если A t o t a l {\displaystyle A_{total}} — полная работа, совершённая над частицей, определяемая как сумма работ, совершенных приложенными к частице силами, то она выражается как:
A t o t a l = Δ ( m v 2 2 ) = Δ E k , {\displaystyle A_{total}=\Delta \left({\frac {mv^{2}}{2}}\right)=\Delta E_{k},}где E k {\displaystyle E_{k}} называется кинетической энергией. Для материальной точки кинетическая энергия определяется как половина произведения массы этой точки на квадрат её скорости и выражается как[5]:
E k = 1 2 m v 2 . {\displaystyle E_{k}={\frac {1}{2}}mv^{2}.}Для сложных объектов, состоящих из множества частиц, кинетическая энергия тела равна сумме кинетических энергий частиц.
Потенциальная энергия
Сила называется потенциальной, если существует скалярная функция координат, известная как потенциальная энергия и обозначаемая E p {\displaystyle E_{p}} , такая что
F → = − ∇ E p . {\displaystyle {\vec {F}}=-\nabla E_{p}.}Если все силы, действующие на частицу консервативны, и E p {\displaystyle E_{p}} является полной потенциальной энергией, полученной суммированием потенциальных энергий соответствующих каждой силе, тогда:
| F → ⋅ Δ s → = − ∇ → E p ⋅ Δ s → = − Δ E p ⇒ − Δ E p = Δ E k ⇒ Δ ( E k + E p ) = 0 {\displaystyle {\vec {F}}\cdot \Delta {\vec {s}}=-{\vec {\nabla }}E_{p}\cdot \Delta {\vec {s}}=-\Delta E_{p}\Rightarrow -\Delta E_{p}=\Delta E_{k}\Rightarrow \Delta (E_{k}+E_{p})=0} . |
Этот результат известен как закон сохранения механической энергии и утверждает, что полная механическая энергия в замкнутой системе, в которой действуют консервативные силы,
∑ E = E k + E p {\displaystyle \sum E=E_{k}+E_{p}}является постоянной во времени. Этот закон широко используется при решении задач классической механики.
Работа в термодинамике
Основная статья: Термодинамическая работаВ термодинамике работа, совершенная газом при расширении[6], рассчитывается как интеграл давления по объёму:
A 1 → 2 = ∫ V 1 V 2 P d V . {\displaystyle A_{1\rightarrow 2}=\int \limits _{V_{1}}^{V_{2}}PdV.}
Работа, совершенная над газом, совпадает с этим выражением по абсолютной величине, но противоположна по знаку.
- Естественное обобщение этой формулы применимо не только к процессам, где давление есть однозначная функция объема, но и к любому процессу (изображаемому любой кривой в плоскости PV), в частности, к циклическим процессам.
- В принципе, формула применима не только к газу, но и к чему угодно, способному оказывать давление (надо только чтобы давление в сосуде было всюду одинаковым, что неявно подразумевается в формуле).
Эта формула прямо связана с механической работой. Действительно, попробуем написать механическую работу при расширении сосуда, учитывая, что сила давления газа будет направлена перпендикулярно каждой элементарной площадке, равна произведению давления P на площадь dS площадки, и тогда работа, совершаемая газом для смещения h одной такой элементарной площадки будет
d A = P d S h . {\displaystyle dA=PdSh.}Видно, что это и есть произведение давления на приращение объема вблизи данной элементарной площадкой. А просуммировав по всем dS получим конечный результат, где будет уже полное приращение объема, как и в главной формуле параграфа.
Работа силы в теоретической механике
Рассмотрим несколько детальнее, чем это было сделано выше, построение определения энергии как риманова интеграла.
Пусть материальная точка M {\displaystyle M} движется по непрерывно дифференцируемой кривой G = { r = r ( s ) } {\displaystyle G=\{r=r(s)\}} , где s — переменная длина дуги, 0 ≤ s ≤ S {\displaystyle 0\leq s\leq S} и на неё действует сила F ( s ) {\displaystyle F(s)} , направленная по касательной к траектории в направлении движения (если сила не направлена по касательной, то будем понимать под F ( s ) {\displaystyle F(s)} проекцию силы на положительную касательную кривой, таким образом сведя и этот случай к рассматриваемому далее). Величина F ( ξ i ) △ s i , △ s i = s i − s i − 1 , i = 1 , 2 , . . . , i τ {\displaystyle F(\xi _{i})\triangle s_{i},\triangle s_{i}=s_{i}-s_{i-1},i=1,2,...,i_{\tau }} , называется элементарной работой силы F {\displaystyle F} на участке G i {\displaystyle G_{i}} и принимается за приближенное значение работы, которую производит сила F {\displaystyle F} , воздействующая на материальную точку, когда последняя проходит кривую G i {\displaystyle G_{i}} . Сумма всех элементарных работ ∑ i = 1 i τ F ( ξ i ) △ s i {\displaystyle \sum _{i=1}^{i_{\tau }}F(\xi _{i})\triangle s_{i}} является интегральной суммой Римана функции F ( s ) {\displaystyle F(s)} .
В соответствии с определением интеграла Римана, можем дать определение работе:
Предел, к которому стремится сумма ∑ i = 1 i τ F ( ξ i ) △ s i {\displaystyle \sum _{i=1}^{i_{\tau }}F(\xi _{i})\triangle s_{i}} всех элементарных работ, когда мелкость | τ | \displaystyle разбиения τ {\displaystyle \tau } стремится к нулю, называется работой силы F {\displaystyle F} вдоль кривой G {\displaystyle G} .
Таким образом, если обозначить эту работу буквой W {\displaystyle W} , то, в силу данного определения,
W = lim | τ | → 0 ∑ i = 1 i τ F ( ξ i ) △ s i {\displaystyle W=\lim _\rightarrow 0\sum _{i=1}^{i_{\tau }}F(\xi _{i})\triangle s_{i}} ,следовательно,
W = ∫ 0 s F ( s ) d s {\displaystyle W=\int \limits _{0}^{s}F(s)ds} (1).Если положение точки на траектории её движения описывается с помощью какого-либо другого параметра t {\displaystyle t} (например, времени) и если величина пройденного пути s = s ( t ) {\displaystyle s=s(t)} , a ≤ t ≤ b {\displaystyle a\leq t\leq b} является непрерывно дифференцируемой функцией, то из формулы (1) получим
W = ∫ a b F [ s ( t ) ] s ′ ( t ) d t . {\displaystyle W=\int \limits _{a}^{b}F[s(t)]s'(t)dt.}Размерность и единицы
Единицей измерения работы в Международной системе единиц (СИ) является джоуль, в СГС — эрг
1 Дж = 1 кг·м²/с² = 1 Н·м 1 эрг = 1 г·см²/с² = 1 дин·см 1 эрг = 10−7 Джru.wikipedia.org
Работа газа
Работа газа A = PV + A(полезн)
Я долго недоумевала, почему полная работа газа подразделяется на работу расширения и полезную работу, если полезная работа как бы и совершается в тепловой машине в процессе расширения.
Теперь появилась догадка, что в формуле под PV имеется ввиду работа не расширения самого газа, а работа СЖАТИЯ, которая совершается НАД газом, для того чтобы замкнуть цикл в тепловой машине, и следовательно, имеет отрицательный знак. Вопрос- так ли это?
И если да, то почему же елки-палки нельзя эту незамысловатую вещь взять и написать в учебнике, а не заставлять пытающихся понять людей изобретать велосипед, когда это ни к чему! Или это я тупая и не понимаю очевидные вещи? Не могу разобраться, в учебниках изъян или во мне
Кот обормот
Газ может расширятся и не совершая работы ( это такое физическое свойство , обьем одного моля газа , при определённой температуре )
При таком расширении газ будет потреблять энергию , на нагрев , не совершая работы .
Читайте также
![Акт определение Акт определение]() Акт определение
Акт определение![База данных определение База данных определение]() База данных определение
База данных определение![Что значит график работы 5 2 Что значит график работы 5 2]() Что значит график работы 5 2
Что значит график работы 5 2![Бетон определение Бетон определение]() Бетон определение
Бетон определение![Генетические механизмы определения пола Генетические механизмы определения пола]() Генетические механизмы определения пола
Генетические механизмы определения пола- Выберите один из вариантов определения истины это
![Вопросы определения Вопросы определения]() Вопросы определения
Вопросы определения- Актив определение
![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Власть определение Власть определение]() Власть определение
Власть определение![Гражданская война определение Гражданская война определение]() Гражданская война определение
Гражданская война определение![Давление определение Давление определение]() Давление определение
Давление определение
 Акт определение
Акт определение База данных определение
База данных определение Что значит график работы 5 2
Что значит график работы 5 2 Бетон определение
Бетон определение Генетические механизмы определения пола
Генетические механизмы определения пола Вопросы определения
Вопросы определения Болезнь определение
Болезнь определение Власть определение
Власть определение Гражданская война определение
Гражданская война определение Давление определение
Давление определение