РАСТВОРЫ
Основные понятия
Растворомназывают гомогенную систему, состоящую из двух или более компонентов.
Один из компонентов раствора – растворитель, остальные – растворенные вещества. Растворителем обычно считают тот компонент, чье агрегатное состояние не изменяется при образовании раствора. Если оба компонента находятся в одинаковом агрегатном состоянии, то растворителем является тот компонент, который находится в большем количестве.
Растворы бывают насыщенными, ненасыщенными и пересыщенными.
Насыщенный раствор – это раствор, который находится в равновесии с твердой фазой растворенного вещества, т.е. содержит максимально возможное количество растворенного вещества при данной температуре.
Ненасыщенный раствор – это раствор, концентрация которого меньше концентрации насыщенного раствора.
Пересыщенный раствор – это раствор, в котором растворяемого вещества содержится больше, чем в насыщенном при данной температуре.
Растворимостью называют способность одного вещества растворятся в другом. Количественно растворимость твердых веществ и жидкостей определяется коэффициентом растворимости. Коэффициент растворимости выражается массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. Обычно вещество считают растворимым (р), если величина коэффициента растворимости превышает 1. При коэффициенте растворимости от 1 до 0,01 вещество мало растворимо (м). При коэффициенте растворимости менее 0,01 вещество практически нерастворимо (н).
Растворение веществ часто сопровождается выделением или поглощением теплоты. Что является следствием химического взаимодействия растворенного вещества с растворителем. Этот процесс называется гидратацией, если растворитель – вода, или сольватацией, если взят неводный растворитель. При этом образуются соединения, который соответственно называются гидратами и сольватами.
Гидраты, как правило, не стойкие вещества. Но некоторые из них настолько прочны, что вода входит в состав кристаллов растворенного вещества. Такие вещества называются кристаллогидратами,а содержащаяся в них вода называется кристаллизационной.
Состав кристаллогидрата изображается формулой, которая показывает какое количество кристаллизационной воды содержится в кристаллогидрате:
· медный купорос (кристаллогидрат сульфата меди) – CuSO4·5H2O;
· глауберова соль (кристаллогидрат сульфата натрия) – Na2SO4·10H2O.
studopedia.ru
Тема 7. Растворы и дисперсные системы Оглавление
Тема 7. Растворы и дисперсные системы 1
7.1.Основные понятия и определения. Структура темы 3
7.1.1.Классификация растворов 3
7.1.2.Структура темы 4
7.2.Дисперсные системы (смеси) их виды 5
7.2.1.Грубодисперсные системы 6
7.2.2.Тонкодисперсные системы (коллоидные растворы) 6
7.2.3.Высокодисперсные системы (истинные растворы) 9
7.3.Концентрация, способы ее выражения 10
7.3.1.Растворимость веществ. 10
7.3.2.Способы выражения концентрации растворов. 11
7.3.2.1.Процентная 12
7.3.2.2.Молярная 12
7.3.2.3.Нормальная 12
7.3.2.4.Моляльная 12
7.3.2.5.Мольная доля 12
7.4.Физические законы растворов 13
7.4.1.Закон Рауля 13
7.4.1.1.Изменение температур замерзания 14
7.4.1.2.Изменение температур кипения 15
7.4.2.Закон Генри 15
7.4.3.Закон Вант-Гоффа. Осмотическое давление 15
7.4.4.Идеальные и реальные растворы. 16
7.4.4.1.Активность – концентрация для реальных систем 17
7.5.Теория растворов 17
7.5.1.Физическая теория 18
7.5.2.Химическая теория 18
7.6.Теория электролитической диссоциации 19
7.6.1.Растворы электролитов 20
7.6.1.1.Константа диссоциации 20
7.6.1.2.Степень диссоциации. Сильные и слабые электролиты 24
7.6.1.3.Закон разведения Оствальда 27
7.6.2.Электролитическая диссоциация воды 27
7.6.2.1.Ионное произведение воды 28
7.6.2.2.Водородный показатель. Кислотность и основность растворов 29
7.6.2.3.Кислотно-основные индикаторы 29
7.7.Реакции ионного обмена. 31
7.7.1.Образование слабого электролита 32
7.7.2.Выделение газа 34
7.7.3.Образование осадков 34
7.7.3.1.Условие образование осадка. Произведение растворимости 34
7.7.4.Гидролиз солей 36
7.7.4.1.Смещение равновесия при гидролизе 38
-
Основные понятия и определения. Структура темы
Дисперсные системы или смеси представляют собой многокомпонентные системы, в которых одно или несколько веществ равномерно распределено в виде частиц в среде другого вещества.
В дисперсных системах различают дисперсную фазу — мелкораздробленное вещество и дисперсионную среду — однородное вещество, в котором распределена дисперсная фаза. Например, в мутной воде, содержащей глину, дисперсной фазой являются твердые частички глины, а дисперсионной средой — вода; в тумане дисперсная фаза — частички жидкости, дисперсионная среда — воздух; в дыме дисперсная фаза —- твердые частички угля, дисперсионная среда — воздух; в молоке — дисперсная фаза — частички жира, дисперсионная среда — жидкость и т. д. Дисперсные системы могут быть как гомогенными так и гетерогенными.
Гомогенная дисперсная система является раствором.
-
Классификация растворов
По размеру растворенных веществ все многокомпонентные растворы разделяют на:
-
грубодисперсные системы (смеси);
-
тонкодисперсные системы (коллоидные растворы);
-
высокодисперсные системы (истинные растворы).
По фазовому состоянию растворы бывают:
-
твердые;
-
жидкие;
-
газовые.
По составу растворенных веществ жидкие растворы рассматривают как:
-
электролиты;
-
неэлектролиты.
-
Структура темы
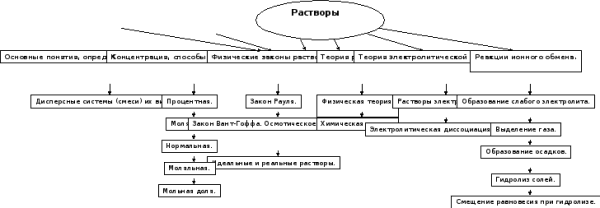
-
Дисперсные системы (смеси) их виды
Дисперсная система— это смесь из двух или более веществ, которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Фазы разделены между собой границей раздела и их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т.д.).
Основные виды дисперсных систем: аэрозоли, суспензии, эмульсии, золи, гели, порошки, волокнистые материалы типа войлока, пены, латексы, композиты, микропористые материалы; в природе - горные породы, почвы, атмосферные осадки.
По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса:
-
Свободнодисперсные системы, у которых дисперсная фаза подвижна;
-
Связнодисперсныесистемы, дисперсионная среда которых твердая, а частицы их дисперсной фазы связаны между собой и не могут свободно перемещаться.
По размеру частиц дисперсной фазы различают грубодисперсные системы (взвеси) с размером частиц более 500 нм и тонкодисперсные (коллоидные растворы или коллоиды) с размерами частиц от 1 до 500 нм.
Таблица 7.1. Разновидность дисперсных систем.
|
Диспер-сионная среда |
Диспер-сная фаза |
Название дисперсной системы |
Примеры дисперсных систем |
|
Газ |
Жидкость |
Аэрозоль |
Туман, облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля. |
|
Твердое вещество |
Аэрозоль |
Дым, смог, пыль в воздухе |
|
|
Жидкость |
Газ |
Пена |
Газированные напитки, взбитые сливки |
|
Жидкость |
Эмульсии |
Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) |
|
|
Твердое вещество |
Золь, суспензия |
Речной и морской ил, строительные растворы, пасты. |
|
|
Твердое вещество |
Газ |
Твердая пена |
Керамика, пенопласты, полиуретан, поролон, пористый шоколад. |
|
Жидкость |
Гель |
Желе, желатин, косметические и медицинские средства (мази, тушь, помада) |
|
|
Твердое вещество |
Твердый золь |
Горные породы, цветные стекла, некоторые сплавы. |
StudFiles.ru
Неводные растворы, определение, характеристика
НЕВОДНЫЕ РАСТВОРЫ. РАСТВОРИТЕЛИ, ХАРАКТЕРИСТИКА. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА В АПТЕЧНЫХ и заводских условиях. НОМЕНКЛАТУРА
План:
1. Неводные растворы, определение, характеристика.
2. Особенности технологии растворов на неводных летучих растворителях.
3. Особенности технологии растворов на неводных нелетучих растворителях.
4. Оценка качества неводных растворов.
Перспективы совершенствования качества и технологии неводных растворов.
Неводные растворы, определение, характеристика.
Неводные растворы -это жидкие лекарственные формы, представляющие собой гомогенные дисперсные системы, структурными единицами в которых являются ионы и молекулы. Эти растворы предназначены главным образом для наружного применения (смазывания, обтирания, примочки, капли для носа, ушные и т.п.). Значительно реже они применяются внутрь, для инъекций и для ингаляций.
Причины применения неводных растворителей:
1. Необходимость получения растворов из трудно растворимых в воде лекарственных веществ;
2. Для устранения гидролиза лекарственных веществ;
3. Возможность пролонгирования действия;
4. Для увеличения стабильности лекарственных веществ в растворе.
К неводным растворам предъявляются требования, аналогичные требованиям к растворам водным, то есть:
- соответствие медицинскому назначению для достижения необходимого лечебного эффекта;
- полнота растворения лекарственных веществ;
- отсутствие механических включений;
- соответствие концентраций лекарственных веществ, объема или массы растворов прописанному;
- стабильность при хранении.
Достоинствами неводных растворов являются:
- простата изготовления;
- разнообразие способов назначения;
- стабильность неводных растворов (они более стабильны, чем водные).
Недостатки:
- невозможность процеживания растворов на вязких растворителях;
- некоторые летучие растворители огнеопасны. Поэтому работу с ними необходимо производить вдали от источников огня.
Растворители, входящие в состав неводных растворов, подразделяют на две группы:
Þ летучие (этанол, диэтиловый эфир, хлороформ);
Þ нелетучие (глицерин, минеральные масла (вазелиновое), силиконы (эсилон 4, 5), полиэтиленоксиды (ПЭО - 400), димексид).
Изготовление растворов на неводных растворителях характеризуется теми же стадиями, что и водных растворов, т.е. отвешивание или отмеривание лекарственных веществ и растворителей, растворение и смешивание, фильтрование, упаковка, оформление. В то же время каждая из этих стадий в технологии неводных растворов имеет свои особенности, обусловленные главным образом физико-химическими свойствами растворителей.
studopedia.ru
Что такое Растворы?Растворитель?и Растворимость? Дайте определение понятиям!
Екатерина муренко
Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.
Химический раствор — это смесь одной или нескольких кислот с водой.
Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Ольka
РАСТВОРЫ — однородные смеси переменного состава. Р. делят на газовые, жидкие и твёрдые. К газовым Р. относят воздух, природные горючие газы и др. ; их чаще называют смесями.
РАСТВОРЫ — гомогенные системы, состоящие из двух или более компонентов, состав к рых в определенных пределах может непрерывно изменя
РАСТВОРИМОСТЬ, способность вещества образовывать с др. веществом (или веществами) гомог. смеси с дисперсным распределением
Растворители — индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов
Читайте также
![Акт определение Акт определение]() Акт определение
Акт определение![Генетическое определение пола кратко Генетическое определение пола кратко]() Генетическое определение пола кратко
Генетическое определение пола кратко![Генетические механизмы определения пола Генетические механизмы определения пола]() Генетические механизмы определения пола
Генетические механизмы определения пола![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Дайте определение понятию авария Дайте определение понятию авария]() Дайте определение понятию авария
Дайте определение понятию авария![Дайте определение социологии Дайте определение социологии]() Дайте определение социологии
Дайте определение социологии![Деталь определение Деталь определение]() Деталь определение
Деталь определение![Закон джоуля ленца формула и определение Закон джоуля ленца формула и определение]() Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение![Здоровье определение Здоровье определение]() Здоровье определение
Здоровье определение![Что такое сила в физкультуре определение Что такое сила в физкультуре определение]() Что такое сила в физкультуре определение
Что такое сила в физкультуре определение![Двигатель определение Двигатель определение]() Двигатель определение
Двигатель определение- Дать определение понятию индустриализация
 Акт определение
Акт определение Генетическое определение пола кратко
Генетическое определение пола кратко Генетические механизмы определения пола
Генетические механизмы определения пола Болезнь определение
Болезнь определение Дайте определение понятию авария
Дайте определение понятию авария Дайте определение социологии
Дайте определение социологии Деталь определение
Деталь определение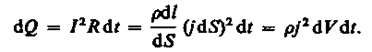 Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение Здоровье определение
Здоровье определение Что такое сила в физкультуре определение
Что такое сила в физкультуре определение Двигатель определение
Двигатель определение