Что такое соль? Формула, свойства соли (химия)
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.
Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
Men m Кислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая - содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые - ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия: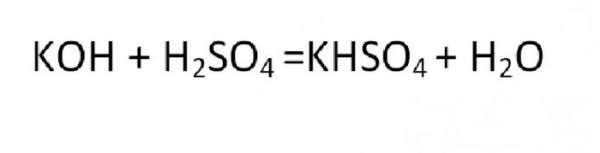
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
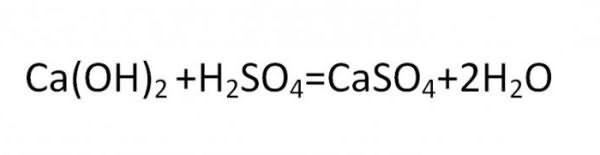
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН-. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.  Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3-.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3-.
Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3-, HCO3 - = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН- . Например, диссоциация хлорида гидроксомагния протекает следующим образом: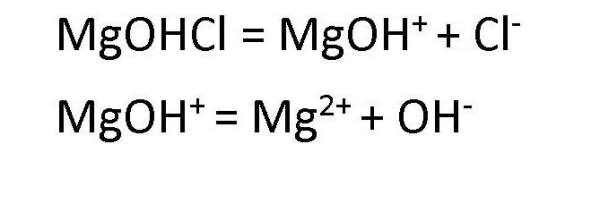
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
syl.ru
Соли. Названия и классификация солей.
В предыдущих разделах постоянно встречались реакции, в которых образуются соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 4.6. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Таблица 4-6. Построение названий солей.
|
Соль какой кислоты |
Кислот-ный остаток |
Валент-ность остатка |
Название солей |
Примеры |
|
Азотная HNO3 |
NO3 |
I |
нитраты |
Ca(NO3)2 нитрат кальция |
|
Кремниевая H2SiO3 |
SiO32 |
II |
силикаты |
Na2SiO3 силикат натрия |
|
Серная H2SO4 |
SO42 |
II |
сульфаты |
PbSO4 сульфат свинца |
|
Угольная H2CO3 |
CO32 |
II |
карбонаты |
Na2CO3карбонат натрия |
|
Фосфорная H3PO4 |
PO43 |
III |
фосфаты |
AlPO4 фосфат алюминия |
|
Бромоводородная HBr |
Br |
I |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I |
I |
иодиды |
KI иодид калия |
|
Сероводородная H2S |
S2 |
II |
сульфиды |
FeS сульфид железа (II) |
|
Соляная HCl |
Cl |
I |
хлориды |
NH4Cl хлорид аммония |
|
Фтороводородная HF |
F |
I |
фториды |
CaF2 фторид кальция |
Из таблицы 4-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид».
В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит».Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 4-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
|
H2SO3 |
+ |
2 NaOH |
= |
Na2SO3 |
+ |
2 H2O |
|
сульфит натрия (средняя соль) |
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
|
H2SO3 |
+ |
NaOH |
= |
NaHSO3 |
+ |
H2O |
|
гидросульфит натрия (кислая соль) |
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
|
Mg(OH)2 |
+ |
2 HCl |
= |
MgCl2 |
+ |
2 H2O |
|
хлорид магния(средняя соль) |
|
Mg(OH)2 |
+ |
HCl |
= |
Mg(OH)Cl |
+ |
H2O |
|
гидроксохлорид магния(основная соль) |
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Однокислотные основания таких солей образовать не могут.
В таблице 4.6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 4.7).
Таблица 4.7. Международные, русские и традиционные названия некоторых важных солей.
|
Соль |
Международное название |
Русское название |
Традиционное название |
Применение |
|
Na2CO3 |
Карбонат натрия |
Натрий углекислый |
Сода |
В быту – как моющее и чистящее средство |
|
NaHCO3 |
Гидрокарбонат натрия |
Натрий углекислый кислый |
Питьевая сода |
Пищевой продукт: выпечка кондитерских изделий |
|
K2CO3 |
Карбонат калия |
Калий углекислый |
Поташ |
Применяется в технике |
|
Na2SO4 |
Сульфат натрия |
Натрий сернокислый |
Глауберова соль |
Лекарственное средство |
|
MgSO4 |
Сульфат магния |
Магний сернокислый |
Английская соль |
Лекарственное средство |
|
KclO3 |
Хлорат калия |
Калий хлорнова-токислый |
Бертолетова соль |
Применяется в зажигательных смесях для головок спичек |
Например, ни в коем случае нельзя путать соду Na2CO3 и питьевую соду NaHCO3. Если нечаянно использовать в пищу соду вместо питьевой соды, можно получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода– вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.


Приведем строение и название основной соли, формула которой выглядит: [Fe(OH)2]2CO3 – дигидроксокарбонат железа (III). При рассмотрении структурной формулы такой соли становится ясно, что эта соль –продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:

StudFiles.ru
Химия 8 класс. Соли. Классификация солей, способы получения солей.
Wolf lone
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
Классификация:
1. Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
2.Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты.
3.Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: .
4. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
5. Смешанные соли — в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды.
6.Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Получение:
1. Реакция нейтрализации. Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно! ) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например: H2SO4+2 KOH=K2SO4+2 H2O
2. Реакция кислот с основными оксидами. Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например: H2SO4+CuO=CuSO4+H2O
3. Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации: Ca(OH)2+CO2=CaCO3+H2O
4. Реакция основных и кислотных оксидов между собой: CaO+SO3= CaSO4
5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок: H2S+CuCl2=CuS (осадок) +2 HCl
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания) . В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например: 3 NaOH+FeCl3=Fe(OH)3+3 NaCl(осадок)
7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок: AgNO3+KCl=AgCl (осадок) +KNO3
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl- + K+ + Br-
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами. В способах 1-7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли: Fe+H2SO4(разб.) =FeSO4+H2
9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым": 2 K+Cl2=2 KCl
10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей: Zn+CuSO4=Cu+ZnSO4
Соли. группы солей их получение и свойства
Денис соколов
Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Общепринятого определения понятия “Соли”, так же как и терминов “кислоты и основания”, продуктами взаимодействием которых соли являются, в настоящее время не существует. Соли могут рассматриваться как продукты замещения протонов водорода кислоты на ионы металлов, NH4+, СН3NН3+ и др. катионы или групп ОН основания на анионы кислот (напр. , Cl-, SO42-).
Классификация
Продуктами полного замещения являются средние соли, например. Na2SO4, MgCl2, неполного-кислые или основные соли, например KHSO4, СuСlOН. Различают также простые соли, включающие один вид катионов и один вид анионов (например, NaCl), двойные соли содержащие два вида катионов (например, KAl(SO4)2 •12H2O), смешанные соли, в составе которых два вида кислотных остатков (например, AgClBr). Комплексные соли содержат комплексные ионы, например K4[Fe(CN)6].
Физические свойства
Типичные соли - кристаллические вещества с ионной структурой, например CsF Существуют также ковалентные соли, например АlСl3. В действительности характер химической связи, v многих солей смешанный.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, за исключением солей поливалентных металлов, гидролизующихся в воде, многие кислые соли.
Таблица - Классификация солей по составу
Средние
(нормальные) - продукт полного замещения атомов водорода в кислоте на металл
AlCl3
Кислые (гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл
КHSO4
Основные (гидроксосоли) -продукт неполного замещения ОН-групп основания на кислотный остаток
FeOHCl
Двойные - содержат два разных металла и один кислотный остаток
КNaSO4
Смешанные - содержат один металл и несколько кислотных остатков
CaClBr
Комплексные
[Cu(NH3)4]SO4
Получение.
1) Взаимодействием металлов с неметаллами: 2Na + Cl2 ® 2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами: CaO + SiO2 CaSiO3 ZnO + SO3 ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами: 2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O + 2HNO3 ® 2NaNO3 + H2O ZnO + H2SO4 ® ZnSO4 + H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH– + ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2 + H2SO4 ® CaSO4¯ + 2H2O Zn(OH)2 + H2SO4 ® ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями: 2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами: ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом: AgNO3 + KCl ® AgCl¯ + KNO3.
Читайте также
![Административное право определение Административное право определение]() Административное право определение
Административное право определение![Аренда определение Аренда определение]() Аренда определение
Аренда определение- Актив определение
![Акт определение Акт определение]() Акт определение
Акт определение![База данных определение База данных определение]() База данных определение
База данных определение![Бетон определение Бетон определение]() Бетон определение
Бетон определение![Брак это определение в производстве Брак это определение в производстве]() Брак это определение в производстве
Брак это определение в производстве![Власть определение Власть определение]() Власть определение
Власть определение![Восприятие определение Восприятие определение]() Восприятие определение
Восприятие определение![Выберите один из вариантов определения бытия Выберите один из вариантов определения бытия]() Выберите один из вариантов определения бытия
Выберите один из вариантов определения бытия![Газоопасные работы определение Газоопасные работы определение]() Газоопасные работы определение
Газоопасные работы определение![Вынесено решение определение что это значит Вынесено решение определение что это значит]() Вынесено решение определение что это значит
Вынесено решение определение что это значит
 Административное право определение
Административное право определение Аренда определение
Аренда определение Акт определение
Акт определение База данных определение
База данных определение Бетон определение
Бетон определение Брак это определение в производстве
Брак это определение в производстве Власть определение
Власть определение Восприятие определение
Восприятие определение Выберите один из вариантов определения бытия
Выберите один из вариантов определения бытия Газоопасные работы определение
Газоопасные работы определение Вынесено решение определение что это значит
Вынесено решение определение что это значит