/ ГОСы Все предметы / Ответы для 5 курса / з3-калия йодид
Задача №3
Провести все виды внутриаптечного контроля для данной лекарственной формы согласно приказа МЗ РФ №214
Rp: Sol. Kaliiiodidi3% - 100 ml
MDS. По 1 ст. л. 2 раза в день
Количественный анализ провести методом аргентометрии (вариант Фаянса)
Дать обоснование метода
Написать уравнения реакций
Сделать расчет допустимых норм отклонений
Рассчитать содержание калия йодида в лекарственной форме
Методика
К 1 мл лекарственной формы (пипетка Мора) прибавить 1 мл воды очищенной, 3 капли разбавленной кислоты уксусной и 1-2 капли эозината натрия. Титровать раствором серебра нитрата (0,1 моль/л) до образования розового осадка над раствором.
M.м. (KI) = 166,01 г/моль
Сделать заключение о качестве препарата (лекарственной формы)
Ответ
На анализ поступила жидкая ЛФ для внутреннего применения – раствор калия йодида3% - 100 мл. Согласно приказа МЗ РФ № 214 проводят следующие виды контроля.
1. Физический контроль.
Бесцветная прозрачная жидкость без механических примесей; допустимая норма отклонений на объем
100 мл ± 3% ± 3 мл
97 мл ≤ х ≤ 103 мл
Вывод: объем ЛФ соответствует прописанному в рецепте.
2. Химический контроль.
Проводится по реакциям на подлинность ионов К+иI-.
1) К+ :
а) Реакция с винно-каменной кислотой в присутствии ацетата натрия и этанола:
K I+ HOOC-CH(OH)-CH(OH)-COOHCH3COONa HOOC-CH(OH)-CH(OH)-COOK+HCl
I+ HOOC-CH(OH)-CH(OH)-COOHCH3COONa HOOC-CH(OH)-CH(OH)-COOK+HCl
Образуется белый осадок гидротартрата калия.
Реакция проводится в присутствии ацетата натрия для создания необходимой кислотности среды.
б) Реакция с раствором кобальтинитрита натрия (гексанитрокобальтата натрия)
2K + + Na3[Co(NO2)6→K2Na[Co(NO2)]6 +2Na+
Реакцию проводят в уксуснокислой среде. Образуется желтый осадок.
в) Пирохимическая реакция.
Бесцветное пламя спиртовки окрашивается в присутствии К+ в фиолетовый цвет.
2) I-:
а) Реакция с раствором нитрата серебра в присутствии азотной кислоты.
КI +AgNO3 →AgI+КNO3
Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака.
б) Реакция окисления йодид-иона до элементарного галогена.
К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2 + 2H2SO4 → I2 + K2SO4 + Na2SO4 + 2NO↑ + 2H2O
Вывод:ЛФ соответствует своему наименованию.
3. Количественный анализ
Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия.
КI +AgNO3 →AgI+КNO3
Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия
По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадкаAgIот желтого до розового.
Расчет титра:
f = 1
Т = ![]() =
=![]() = 0,01660 г/мл
= 0,01660 г/мл
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г калия йодида
Расчет допустимых норм отклонений:
Масса KI= 3,0 г (по рецепту)
3,0 ± 4% ± 0,12
2,88 ≤ х ≤ 3,12
Формула расчета
X(KI) = ![]()
где V(AgNO3) – количество титрантаAgNO3, пошедшего на титрование;
k(AgNO3)·- поправочный коэффициент;
Т (KI) ·- титр калия йодида по серебра нитрату;
V(лф) – объем прописанной ЛФ;
а (лф) – навеска, взятая на титрование.
Заключение о качестве ЛФ.
StudFiles.ru
/ ДЛЯ ГОСОВ / Фарм-химия-прак-11 / ГАК-3-калия йодид
Гоу впо пензенский государственный университет
Медицинский институт
Специальность «Фармация»
Итоговый междисциплинарный экзамен
Эталон ответа к ситуационной задаче №3А
На анализ поступила жидкая ЛФ для внутреннего применения – раствор калия йодида3% - 100 мл. Согласно приказа МЗ РФ № 214 проводят следующие виды контроля.
1. Физический контроль.
Бесцветная прозрачная жидкость без механических примесей; допустимая норма отклонений на объем
100 мл ± 3% ± 3 мл
97 мл ≤ х ≤ 103 мл
Вывод: объем ЛФ соответствует прописанному в рецепте.
2. Химический контроль.
Проводится по реакциям на подлинность ионов К+иI-.
1) К+ :
а) Реакция с винно-каменной кислотой в присутствии ацетата натрия и этанола:
K I+ HOOC-CH(OH)-CH(OH)-COOHCH3COONa HOOC-CH(OH)-CH(OH)-COOK+HCl
I+ HOOC-CH(OH)-CH(OH)-COOHCH3COONa HOOC-CH(OH)-CH(OH)-COOK+HCl
Образуется белый осадок гидротартрата калия.
Реакция проводится в присутствии ацетата натрия для создания необходимой кислотности среды.
б) Реакция с раствором кобальтинитрита натрия (гексанитрокобальтата натрия)
2K + + Na3[Co(NO2)6→K2Na[Co(NO2)]6 +2Na+
Реакцию проводят в уксуснокислой среде. Образуется желтый осадок.
в) Пирохимическая реакция.
Бесцветное пламя спиртовки окрашивается в присутствии К+ в фиолетовый цвет.
2) I-:
а) Реакция с раствором нитрата серебра в присутствии азотной кислоты.
КI +AgNO3 →AgI+КNO3
Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака.
б) Реакция окисления йодид-иона до элементарного галогена.
К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2 + 2H2SO4 → I2 + K2SO4 + Na2SO4 + 2NO↑ + 2H2O
Вывод:ЛФ соответствует своему наименованию.
3. Количественный анализ
Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия.
КI +AgNO3 →AgI+КNO3
Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия

По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадкаAgIот желтого до розового.
Расчет титра:
f = 1
Т = ![]() =
=![]() = 0,01660 г/мл
= 0,01660 г/мл
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г калия йодида
Расчет допустимых норм отклонений:
Масса KI= 3,0 г (по рецепту)
3,0 ± 4% ± 0,12
2,88 ≤ х ≤ 3,12
Формула расчета
X(KI) = ![]()
где V(AgNO3) – количество титрантаAgNO3, пошедшего на титрование;
k(AgNO3)·- поправочный коэффициент;
Т (KI) ·- титр калия йодида по серебра нитрату;
V(лф) – объем прописанной ЛФ;
а (лф) – навеска, взятая на титрование.
Заключение о качестве ЛФ.
Зам. председателя ГАК, доцент Сидорова Е.Ф.
StudFiles.ru
/ АРГЕНТОМЕТРИЯ. остаток лекции
Количественное определение
АРГЕНТОМЕТРИЯ
-
Аргентометрический методоснован на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
MeHal + AgNO3 → AgHal↓+ MeNO3
F (ЛВ) =1
(ЛВ) =1
Метод является фармакопейным и используется в экспресс-анализе
Для количественного определения натрия и калия галогенидов в ЛП используются варианты метода:
Вариант Мора (прямое титрование); индикатор - калия хромат.
Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0.
Натрия хлорид, калия хлорид, натрия бромид, калия бромид.
NaCI + AgNO3 → AgCI↓ + NaNO3
NaBr + AgNO3 → AgBr↓+ NaNO3
Реакция индикации: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
коричневато- красный,
оранжево-красный
(оранжево-желтый ГФ Х)
Осадок Ag2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимости AgCI↓ и AgBr↓.
Роль рН среды:
А) В кислой среде рН,т.к. в кислой среде хромат-ион CrO42-переходит в дихроматCr2O72 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7-(равновесие реакции диссоциации CrO42-смещено вправо)
2CrO4 + 2H+ ↔ 2HCrO4 -↔ Cr2O72- + Н2O
Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду
AgNO3 +OH-→ AgOH↓ + NO3-
2 AgOH→ Ag2O + H2O
Натрия йодид и калия йодид методом Мора не определяют, т.к.
1) йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты),
2) окраска осадков серебра йодида и серебра хромата близка по цвету.
Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды.
Вариант Фаянса (прямое титрование). Титрант: раствор серебра нитрата.
Индикаторы - адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI.
Натрия йодид, калия йодид; Титрант: раствор серебра нитрата.
индикатор - натрия эозинат. Среда - уксуснокислая (разбавленная CH3COOH).
а) NaInd ←→ Ind- + Na+
Эозинат натрия
б) NaI + AgNO3→ AgI↓ + NaNO3
в) Ind- + AgI↓ + AgNO3 → [(AgI)Ag+]Ind-↓ + NO3-
Изб.капля Розовый осадок
В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I- . Будет формироваться коллоидная частица
AgI·nI- ·nК+
Ионы индикатора в этот момент не адсорбируются, а остаются в растворе.
В т.э. после полного осаждения йод-ионовI- в избытке Аg+ осадок будет адсорбировать Аg+ и знак заряда частиц осадка будет меняться на положительный
AgI·nAg+
Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение
AgI·nAg+·nInd- (от розового в растворе до розового на осадке).
Т.о. титрование заканчивается при образовании розового осадка.
На точность фиксации т.э. влияет:
-
величина рН. Адсорбционные индикаторы являются слабыми протолитами, поэтому титрование при определенном значении рН в уксуснокислой среде
-
концентрация раствора. С ↑ площади поверхности осадка - ↑ количество адсорбированных молекул индикатора и более резкое изменение окраски в т.э. При увеличении концентрации иодид-ионов в растворе повышается точность.
-
посторонние ионы. Адсорбционные индикаторы чувствительны к значению ионизации посторонних ионов в растворе. Это учитывается при определении йодидов в многокомпонентных смесях.
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин - прокаин).
Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности.
R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3
Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор - железоаммонийные квасцы.
NaCI +AgNO3(избыток) → AgCI↓ + NaNO3
AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3
Реакция индикации
NH4SCN+NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O
красное окр.
Вариант Кольтгофа (прямое титрование).
Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaCI, KCI, CaCl2, NaBr, KBr).Титрант: раствор серебра нитрата.
Индикатор: йодкрахмальный - 1 капля раствора калия йодата (0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания.
Уравнение индикации
KIO3 + 5KI + 3H2SO4→3I2+ 3K2SO4 + ЗН2O
I2 + KI + крахмал синее окрашивание
По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом:
KI + AgNO3 → Agl↓+ KNO3
В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора.
Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПРAgI = 1,5 • 10-16; ПР AgBr = 4,4 • 10-13; ПР AgCI = 1,8· 10-10).
Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат - дорогостоящий реактив, поэтому метод не экономичен.
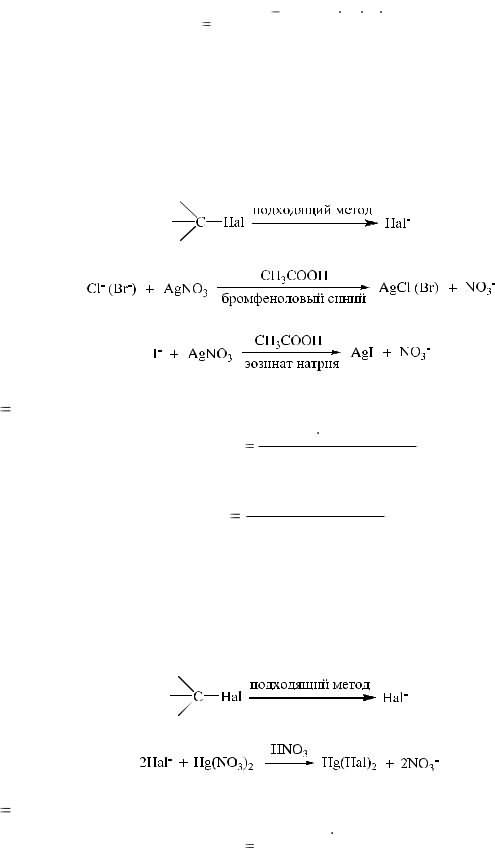
2. Меркуриметрический метод.Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (П). Применяют для всех галогенидов натрия и калия.
Титранты - легко ионизированные соли ртути (II): ртути (II) нитрат -Hg(NO3)2, ртути (II) перхлорат - Hg(CIO4)2. Среда: азотнокислая.
Индикатор: дифенилкарбазон.
2MeHal + Hg(NO3)2 → HgHal2 + 2MeN03
F (MeHaL) =1
(MeHaL) =1
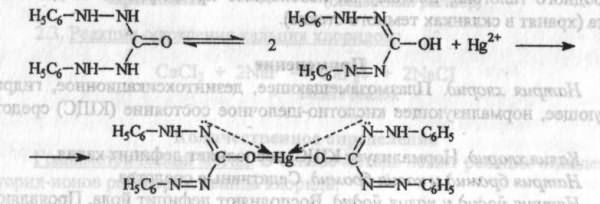
Светло-сиреневое окрашивание.
Йодиды натрия и калиятитруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов.
Титрант:ртути (И) перхлорат (0,01 моль/л) УЧ [1/2Hg(ClO4)2]
2KI+Hg(ClO4)2→HgI2+ 2КСlO4
Спирт: вода (1:1)
F (ЛВ)=1
(ЛВ)=1
3. Броматометрический метод. Используется в анализе йодидов калия и натрия.
Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
6KI + KBrO3 + 6HCI → 3I2 + 6КС1 + KBr + ЗН2O
3I2 + KBrO3 + 6HCI → 6ICI + KBr + ЗН2O
Суммарное уравнение:
6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6Н2O
Уравнение после сокращения коэффициентов:
3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3Н2O
F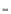 (MeI) =1/2 I
(MeI) =1/2 I -2ē → I+
-2ē → I+
Хранение
ХУТ – для хлорида калия и хлорида натрия, ХУТ + темное стекло – для бромида калия и бромида натрия, ХУТ +темное стекло + сухое место – для йодида калия и йодида натрия.
В хорошо укупоренной таре, в сухом месте (натрия бромид и йодид, калия йодид - гигроскопичны). Бромиды и йодиды легко окисляются до свободного галогена, поэтому их необходимо хранить в защищенном от света месте (в склянках темного стекла).
Применение
Натрия хлорид, Плазмозамещающее, дезинтоксикационное, гидратирующее, нормализующее кислотно-щелочное состояние (КЩС).
Калия хлорид. Нормализует КЩС, восполняет дефицит калия.
Натрия бромид и калия бромид. Седативные средства.
Натрия йодид и калия йодид. Восполняют дефицит йода. Проявляют противомикробное, протеолитическое, муколитическое действие.
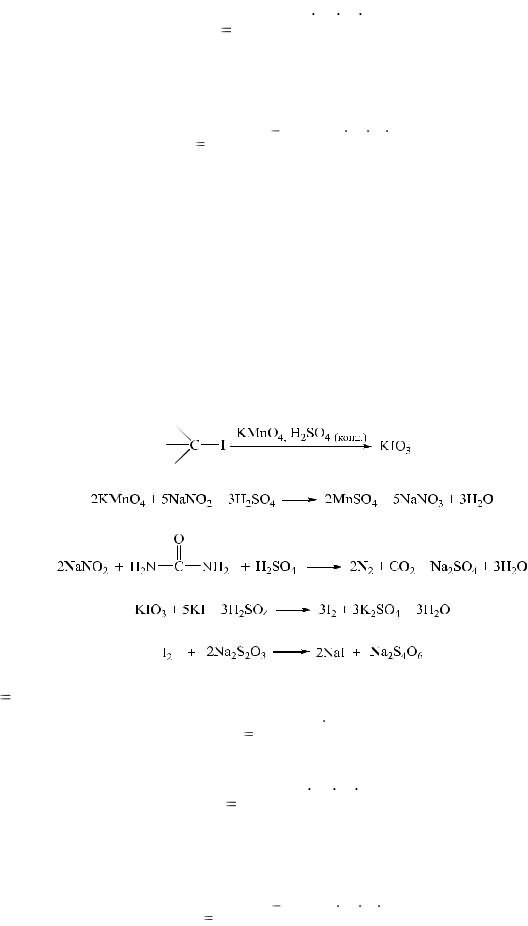
Последовательное доказательство галогенидов в лекарственных формах.
В случае совместного присутствия галогенидов в лекарственных формах для их доказательства используют прием последовательного окисления сильным окислителем - калия перманганатом в кислой среде.
Сначала окисляются более сильные восстановители - йодиды, реакция сопровождается образованием свободного йода, придающего анализируемому раствору темно-бурую окраску; если добавить хлороформ, его слой окрашивается в фиолетовый цвет
10KI + 2KMnO4 + 8H2SO4 →5I2 + 6K2SO4 + 2MnSO4 + 8Н2O
При дальнейшем добавлении окислителя образовавшийся на первой стадии йод окисляется до йодата (йодноватой кислоты), при этом водный и хлороформный слои обесцвечиваются
I2 + 2KMnO4 + 3H2SO4 → 2НIO3 + K2SO4 + 2MnSO4 + 2Н2O бесцветный
После того, как йодиды будут окислены до йодатов, дальнейшее добавление окислителя - калия перманганата приведет к окислению бромидов
10КВг + 2KMnO4 + 8H2SO4→ 5Br2 + 6K2SO4 + 2MnSO4 + 8Н20
Раствор при этом окрашивается в желто-бурый цвет; добавляют хлороформ - бром лучше растворяется в хлороформе, чем в воде, взбалтывают анализируемый раствор с хлороформом до полного обесцвечивания (хлороформный слой окрашен в желто-бурый цвет) водного слоя. После отстаивания слоев водный слой отделяют, избыток калия перманганата удаляют добавлением по каплям раствора пероксида водорода и затем в этом растворе доказывают наличие хлорид-иона реакцией с серебра нитратом.
StudFiles.ru
Количественное определение галогенидов

Эту реакцию можно положить в основу количественного определения фторсодержащих веществ фотоэлектроколориметрическим методом или титриметрическим, используя в качестве титранта циркония нитрат.
Также фториды можно определять по реакции с солями кальция по образованию нерастворимого белого осадка кальция фторида:
Для количественного определения галогенидов используются аргентометрические методы Фольгарда и Фаянса, меркуриметрические методы.
1. Метод Фольгарда (аргентометрия).
Этот метод является универсальным. После переведения ковалентносвязанного галогена в ионное состояние подходящими методами проводят титрование избытка серебра нитрата раствором аммония тиоцианата в азотнокислой среде, в качестве индикатора используют раствор железоаммониевых квасцов:
f 1.
X%
|
TAgNO / препарат |
Сэ(AgNO )M (1/ z)препарата |
, |
||||
|
3 |
||||||
|
1000 |
||||||
|
3 |
||||||
|
(VAgNO3 K AgNO3 |
VNH4 NCS |
K NH4 NCS ) T 100 |
||||
|
. |
||||||
|
a |
||||||
8
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V к.о. |
V |
NH NCS |
) K T 100 |
||
|
X % |
NH NCS |
. |
|||
|
4 |
4 |
||||
a
2. Метод Фаянса (аргентометрия).
После перевода галогена в ионное состояние осуществляют титрование в слабо уксуснокислой среде в присутствии адсорбционных индикаторов. При титровании хлоридов и бромидов применяют бромфеноловый синий, а при титровании йодидов – эозинат натрия:
f 1.
TAgNO / препарат
3
X%
Сэ(AgNO )M (1/ z)препарата,
3
1000
VAgNO3  K
K T
T 100.
100.
a
3. Меркуриметрический метод.
После перевода галогена в ионное состояние проводят титрование раствором ртути (II) нитрата в азотнокислой среде. В качестве индикатора используют дифенилкарбазид:
f 1.
|
THg(NO ) / препарат |
Сэ(Hg(NO ) |
) |
M (1/ z)препарата |
, |
|||
|
3 |
2 |
||||||
|
1000 |
|||||||
|
3 |
2 |
||||||
9
|
X% |
VHg( NO ) |
K T 100 |
|||||||||
|
3 |
2 |
. |
|||||||||
|
a |
|||||||||||
|
Расчетная формула содержания препарата с учетом контрольного |
|||||||||||
|
опыта: |
|||||||||||
|
(V |
Hg ( NO) |
V |
к.о. |
) K T 100 |
|||||||
|
X % |
Hg ( NO) |
. |
|||||||||
|
3 |
2 |
3 |
2 |
||||||||
a
4.Йодиметрия.
Вслучае мокрой окислительной минерализации количественное определение сводится к следующему. Минерализацию проводят калия перманганатом в кислой среде. Избыток калия перманганата восстанавливают натрия нитритом, а избыток последнего удаляют мочевиной, в противном случае эти окислители будут реагировать с калия йодидом. В полученный раствор добавляют калия йодид и титриметрически определяют выделившийся йод. Таким образом, этот метод можно использовать для количественного определения йодсодержащих лекарственных веществ.
f 1/2 .
|
Сэ( Na S O) |
M (1/ z)препарата |
||||||
|
2 |
2 |
3 |
|||||
|
TNa S O / препарат |
, |
||||||
|
1000 |
|||||||
|
2 |
2 |
3 |
|||||
|
VNa S O |
K T 100 |
|||||||||||
|
X% |
2 |
2 |
3 |
. |
||||||||
|
a |
||||||||||||
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||||
|
опыта: |
||||||||||||
|
(VNa S O |
к.о. |
) K T 100 |
||||||||||
|
X % |
VNa S O |
. |
||||||||||
|
2 |
2 |
3 |
2 |
2 |
3 |
|||||||
a
10
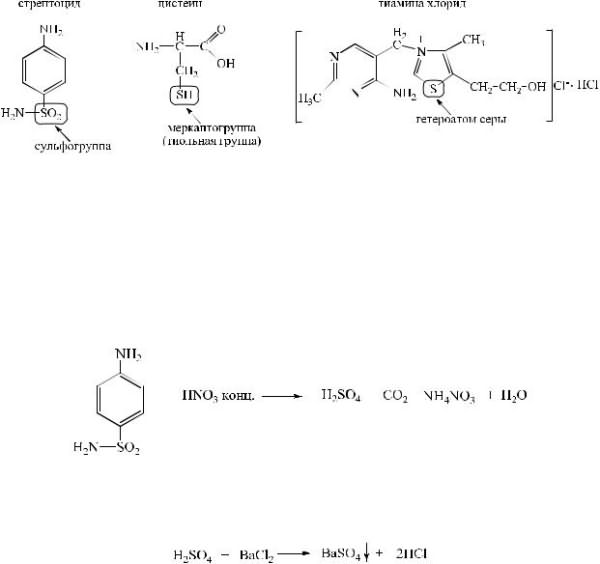
2.МЕТОДЫ ИССЛЕДОВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ КОВАЛЕНТНО-СВЯЗАННЫЙАТОМ СЕРЫ
Впрепаратах органической природы встречается ковалентносвязанный атом серы в виде сульфогруппы, тиольной группы, а также гетероатом серы.
Методы идентификации органических соединений, содержащих ковалентно-связанныйатом серы
1. Наличие серы в сульфо-группемолекулы серосодержащего соединения можно установить окислением органической части молекулы кислотой азотной концентрированной или сплавлением с десятикратным количеством калия (натрия) нитрита досульфат-иона.
Выделившийся сульфат-ионидентифицируют раствором бария сульфата, выпадает белый осадок.
2. Для обнаружения серы в тиольной группе препарат сплавляют с 30% раствором натрия гидроксида, происходит разрушение молекулы серосодержащего соединения с образованием меркаптана и сульфидов.
11
StudFiles.ru
Количественное определение
Натрия и калия хлориды раздельно определить в данной прописи методиками, принятыми в экспресс-анализе, невозможно (кальция хлорид определяют комплексиметрически). Сумму хлоридов натрия и калия рассчитывают по формуле:
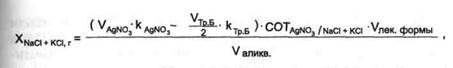 |
где VAgNO — объем 0,1 н. раствора серебра нитрата, пошедший на титрование суммы хлоридов натрия, калия и кальция; VT Б — объем трилона Б, пошедший на титрование кальция хлорида; COT^q /Naci+Kci — сРеДний ориентировочный титр при титровании натрия и калия хлоридов 0,1 н. раствором серебра нитрата.
Значение СОТ 0,1 н. раствора серебра нитрата для суммы натрия и калия хлоридов рассчитывают следующим образом:

Специфическими примесями для калия и натрия бромида быть ионы йодидов, бария, кальция, броматов. Йодиды удаляют с помощью слабого окислителя, каким является железо хлорид, не окисляющий бромиды:
2Fe3+ + 2I- = 2Fe2+ + I2.
Выделяющийся йод обнаруживают в присутствии крахмала по синему окрашиванию.
Ионы бария, кальция и бромат-ион идентифицируют одним реактивом — концентрированной H2S04. При добавлении реагента к испытуемому раствору не должно, согласно требованиям ГФ появляться помутнения или окрашивания (соли бария и кальция дают нерастворимые сульфаты, а броматы в присутствии 6poма в кислой среде выделяют бром, придающий раствору желтый оттенок
ВrO3- + 5Вг + 6Н+ = Br2 + 3Н2O.
Общий способ количественного определения йодидов по ГФ — прямая аргентометрия с применением адсорбционного индикатора (метод Фаянса).
Сущность метода заключается в том, что адсорбционный индикатор (по ГФ — натрия эозинат) не меняет своего окрашивания (желтовато-красного) до наступления точки эквивалентности.
 |
В точке эквивалентности индикатор адсорбируется на осадке серебра йодида, и цвет осадка становится красно-фиолетовым. Это объясняется тем, что до точки эквивалентности на осадке серебра йодида адсорбируется неоттитрованный йодид-ион (как ион, входящий в состав осадка). Возникающий на поверхности осадка отрицательный заряд препятствует адсорбции на нем индикатора в виде аниона. После того как йодид будет оттитрован полностью, на поверхности осадка будут адсорбироваться ионы серебра (также входящие в состав осадка). При этом на поверхности осадка возникает вызванный ионами серебра положительный заряд, и тогда происходит адсорбция анионов индикатора, вызывающая переход окрашивания осадка. В итоге соединение, находящееся в осадке, примет следующий вид:
Agl • Ag+ • Ind
studopedia.ru
Ситуационная задача №. 1. При проведении оценки качества калия йодида в образцах одной серии внешний вид не отвечал требованиям НД по разделу «Описание» - порошок был влажным и
1. При проведении оценки качества калия йодида в образцах одной серии внешний вид не отвечал требованиям НД по разделу «Описание» - порошок был влажным и желтоватого цвета. Дайте обоснование причинам изменения его качества по данному показателю в соответствии с условиями хранения и свойствами. Приведите другие испытания, характеризующие его качество.
· Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость) и их использование для оценки качества.
· В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Kalii jodidum Калия йодид
Potassium Yodide М.м. 166,01
KJ
Получение.
1) Из йодида закисно - окисного железа действия калия карбонатом
Fe3J8 + 4К2СО3 + 4Н2О →8KJ + Fe(OH)2↓ + 2Fe(OH)3↓ + 4СО2↓
2) Путем действия йода на калия гидроксид.
6КОН + 3J2 → KJО3 + 5KJ + ЗН2О
2К J О3 + ЗС→ 2KJ + ЗСО2↑
Описание.Бесцветные или белые кубические кристаллы или белый кристаллический порошок без запаха, солено - горького вкуса. На влажном воздухе сыреет.
Растворимость.Очень легко растворим в воде, легко растворим в спирте.
Одна из серий фармацевтической субстанции калия йодида не отвечал требованиям НД по разделу «Описание» - порошок был влажный и желтоватого цвета, т.к. хранился в плохо закупоренной склянке во влажном воздухе и, обладая восстановительными свойствами под действием кислорода воздуха, окислился до свободного йода и стал жёлтым.
Подлинность.
Препарат дает характерные реакции на йодид-ион и калий.
1)Качественные реакции на йодид-ион.
1.1 KJ + AgNО3 → AgJ↓ + KNO3
Образуется желтый творожистый осадок йодида серебра
НС1
1.2 KJ + 2FeCl3 → J2+ 2FeCl2 + 2КС1
СНС13 фиолетовое окрашивание
2)Качественные реакции на катион К+ :
2.1 KJ + NaHC4H406 →KHC4H4О6↓+ NaJ
белый кристаллический осадок
КНС4Н406 + НСl →КСl + Н2С4Н4О6
КНС4Н4О6 + КОН → К2С4Н406 +Н2О
2.2 2KJ + Na3[Co(NО2)6] → K2Na[Co(NО2)6] + 2NaJ
Гексанитрокобальтат натрия желтый кристаллический осадок
2.3 Соль калия окрашивает бесцветное пламя горелки в фиолетовый цвет.
studopedia.ru
Количественное определение
К 2 мл разведенного раствора (10:100) прибавляют 25 мл воды, 5 ил аммиачного буферного раствора, 0,1 г индикаторной смеси кислотного хромчерного специального и титруют 0,05 моль/л раствором трилона Б до синего окрашивания. Параллельно проводят контрольный опыт.1 мл 0,05 моль/л раствора трилона Б соответствует 0,01232 г магния сульфата
| дата | Характер и содержание выполненной работы | Подпись | |||
| 22.03. | Пропись 1 . Раствор калия хлорида 1%, 5% и 10% Состав: Калия хлорида 10 г, 20 г или 100 г Воды для инъекций до 1 л Определение подлинности: Калий - ион. К 2 мл раствора прибавляют 0,5 мл уксусной кислоты, 0,5 мл натрия кобальтинитрита. Образуется желтый кристаллический осадок Хлорид - ион. К 3-5 кап. раствора прибавляют по 3-5 кап. разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака. Количественное определение: Калия хлорид. К 1 мл 1% или 2 мл разведения для 5% и 10% (1:20) растворов прибавляют 2-3 кап. раствора хромата калия и титруют 0,1 н. раствором серебра нитрата до оранжево - желтого окрашивания. 1 мл 0,1 н. раствора серебра нитрата соответствует 0,007456 г калия хлорида. Припись 2. Раствор амидопирина 5% Состав: Амидопирина 50 г Воды для инъекций до 1 л Определение подлинности: Плотность 1,0032 Амидопирин. К 2 мл раствора прибавить 2 кап. раствора хлорида окисного железа. Образуется синее быстро исчезающее окрашивание, а затем - хлопьевидный коричневый осадок. После подкисления несколькими каплями разведенной соляной кислоты окраска становиться сине - фиолетовой. Количественное определение. Амидопирин. К 1 мл раствора прибавить 2 кап. раствора метилового оранжевого, 1 кап. раствора метиленовой сини и титруют 0,1 н. раствором соляной кислоты до красновато - фиолетовой окраски. 1 мл 0,1 н. раствора соляной кислоты соответствует 0,0231 г амидопирина. Пропись 3. Кислота 10% хлористоводородная НС1 Описание.Бесцветная прозрачная летучая жидкость, своеобразного запаха, кислого вкуса. Плотность 1,0474 Растворимость.Смешивается с водой и спиртом во всех соотношениях, образуя растворы сильно кислой реакции. Подлинность. К 2—3 каплям раствора прибавляют по 2—3 капли разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака Свободный хлор.5 мл препарата смешивают с 5 мл воды, добавляют 1 мл раствора йодида калия, 1 мл хлороформа и взбалтывают. В течение 1 минуты хлороформный слой не должен окрашиваться в розовый или фиолетовый цвет. Сернистая кислота.К 50 мл воды прибавляют 0,1 мл 0,01 н. раствора йода й 1 мл раствора крахмала. К. окрашенной в синий цвет жидкости прибавляют 5 мл препарата, разбавленных 4 мл воды; в течение полминуты раствор не должен обесцвечиваться. Сульфаты. 5 мл препарата разбавляют водой до 50 мл. 10 мл полученного раствора не должны давать реакции на сульфаты. Тяжелые металлы. 10 мл того же раствора не должны давать реакции на тяжелые металлы. Железо. 10 мл препарата не должны содержать железа- более, чем 3 мл эталонного раствора, разведенного водой до 10 мл (не более ,0001% в препарате). Сульфатная зола из 10 мл препарата не должна превышать 0,01%. Мышьяк. 3 мл препарата не должны давать реакции на мышьяк. Количественное определение. Титруют 5 мл разведенного раствора (20:100) ОД моль/лраствором натрия гидрооксида до желтого окрашивания (индикатор — метиловый оранжевый). 1 мл 0,1 моль/л раствора натрия гидр оксида соответствует 0,04393 г кислоты хлористоводородной разведенной Хранение. Список Б. В склянках с притертыми пробками. | ||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 23.03. | Внутриаптечная заготовка Пропись 1 Раствор пероксида водорода 3% Перекись водорода (H2O2, пергидроль) Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O. Систематическое наименование Пероксид водорода Химическая формула H2O2 Отн. молек. масса 34,01 а. е. м. Молярная масса 34,01 г/моль Физические свойства Плотность вещества 1.4 г/см³ Состояние (ст. усл.) жидкость Термические свойства Температура плавления −0,432 °C Температура кипения 150,2 °C Энтальпия (ст. усл.) -136.11 кДж/моль Химические свойства pKa 11.65 Растворимость в воде неограниченная г/100 мл Идентификация. 2 капли раствора наносят на фарфоровую чашечку, прибавляют 1 каплю разведенной серной кислоты, 3-4 капли эфира, 1 каплю раствора калия дихромата; эфирный слой окрашивается в синий цвет. Количественное определение Раствор пероксида водорода 3% - 50 мл 1 мл раствора помещают в мерную колбу емкостью 50 мл и доводят водой до метки. 1 мл разведения помещают в колбочку, приливают 5 мл разведенной серной кислоты и титруют раствором калия перманганата (0,02 моль/л, УЧ 1/5 KMnO4) до слабо-розовой окраски. М.м. 30,01. Пропись 2. Раствор глюкозы 5, 10, 20, 25% для инъекций. Раствор глюкозы 5, 10, 20, 25% для инъекций. Состав: Глюкозы безводной 50, 100, 200, 250 г. Раствор кислоты хлороводородной (0,1 моль/л) до рН 3,0-4,1-5 мл Натрия хлорида 0,26 г. Воды для инъекций до 1 л Описание. Прозрачная бесцветная жидкость. Подлинность. Глюкоза. 1. К 0,5 мл раствора прибвляют 3мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок. 2. Помещают 2-3 капли раствора в фарфоровую чашку и выпаривают на водяной бане досуха. После охлаждения к сухому остатку прибавляют 0,01 г тимола, 5-6 капель концентрированной серной кислоты и 2 капли воды. Появляется красно-фиолетовое окрашивание. Хлорид-ион. К 1 мл раствора прибавляют по 2-3 капли кислоты азотной разведенной и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака. Натрий-ион. Графитовую палочку, смоченную раствором, вносят в бесцветное пламя. Пламя окрашивается в желтый цвет. Кислотность. 1. К 2-3 мл раствора прибавляют 1 каплю раствора метилового красного. Раствор окрашивается в красный цвет. 2. К 2-3 мл раствора прибавляют 1 каплю метилового оранжевого. Раствор окрашивается в розовый цвет. рН 3,0-4,1 (потенциометрически или по универсальной индикаторной бумаге). Количественное определение. Глюкоза (м.м. 180,14) 1.Рефрактометричекий метод. Содержание глюкозы (Х) в г в 1 мл раствора вычисляют по формуле: 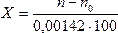 Содержание глюкозы в 1 мл раствора должно быть 0,0485-0,0515; 0,097-0,103; 0,194-0,206; 0,242-0,258г. 2.Иодометрический метод. 5 мл раствора помещают в мерную колбу вместимостью 25 мл и доводят водой до метки. 1 мл разведения помещают в склянку с притертой пробкой, прибавляют 2,5 мл раствора йода (0,1 моль/л) УЧ (1/2 I2), 0,5 мл раствора натрия гидроксида (1 моль/л) и оставляют в темном месте на 5 минут. Затем прибавляют 0,5 мл кислоты серной разведенной. Избыток йода оттитровывают раствором натрия тиосульфата (0,1 моль/л). Индикатор – крахмал. Параллельно проводят контрольный опыт. Определение стабилизатора в растворе глюкозы. Вариант1. Кислота хлороводородная. К 25 мл раствора прибавляют 1 каплю метилового красного и титруют раствором натрия гидроксида (0,02 моль/л) от красного до желтого окрашивания (А мл). 1 мл раствора натрия гидроксида (0,02 моль/л) соответствует 0,0007292 г хлороводорода. Содержание раствора хлороводородной кислоты (0,1 моль/л) (Х) в 1 мл раствора вычисляют по формуле: Содержание глюкозы в 1 мл раствора должно быть 0,0485-0,0515; 0,097-0,103; 0,194-0,206; 0,242-0,258г. 2.Иодометрический метод. 5 мл раствора помещают в мерную колбу вместимостью 25 мл и доводят водой до метки. 1 мл разведения помещают в склянку с притертой пробкой, прибавляют 2,5 мл раствора йода (0,1 моль/л) УЧ (1/2 I2), 0,5 мл раствора натрия гидроксида (1 моль/л) и оставляют в темном месте на 5 минут. Затем прибавляют 0,5 мл кислоты серной разведенной. Избыток йода оттитровывают раствором натрия тиосульфата (0,1 моль/л). Индикатор – крахмал. Параллельно проводят контрольный опыт. Определение стабилизатора в растворе глюкозы. Вариант1. Кислота хлороводородная. К 25 мл раствора прибавляют 1 каплю метилового красного и титруют раствором натрия гидроксида (0,02 моль/л) от красного до желтого окрашивания (А мл). 1 мл раствора натрия гидроксида (0,02 моль/л) соответствует 0,0007292 г хлороводорода. Содержание раствора хлороводородной кислоты (0,1 моль/л) (Х) в 1 мл раствора вычисляют по формуле: 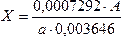 , где 0,003646 – содержание хлороводорода в 1 мл раствора кислоты хлороводородной (0,1 моль/л), а – навеска лекарственной формы (25 мл). Натрия хлорид и кислота хлороводородная. К 2 мл раствора прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,02 моль/л) до появления красноватого осадка (Б, мл). М.м. натрия хлорида 58,44 Содержание натрия хлорида (Х) в г в 1 мл вычисляют по формуле: , где 0,003646 – содержание хлороводорода в 1 мл раствора кислоты хлороводородной (0,1 моль/л), а – навеска лекарственной формы (25 мл). Натрия хлорид и кислота хлороводородная. К 2 мл раствора прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,02 моль/л) до появления красноватого осадка (Б, мл). М.м. натрия хлорида 58,44 Содержание натрия хлорида (Х) в г в 1 мл вычисляют по формуле: 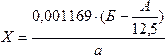 Вариант2. К 25 мл раствора глюкозы прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка. 1 мл раствора серебра нитрата (0,1 моль/л) соответствует 0,0097 г суммы натрия хлорида и кислоты хлороводородной разведенной, которых в 1 мл раствора должно быть 0,00043-0,00053 г. Содержание суммы натрия хлорида и кислоты хлороводородной разведенной (Г∑) в г 1 мл раствора рассчитывают по формуле: Вариант2. К 25 мл раствора глюкозы прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка. 1 мл раствора серебра нитрата (0,1 моль/л) соответствует 0,0097 г суммы натрия хлорида и кислоты хлороводородной разведенной, которых в 1 мл раствора должно быть 0,00043-0,00053 г. Содержание суммы натрия хлорида и кислоты хлороводородной разведенной (Г∑) в г 1 мл раствора рассчитывают по формуле: 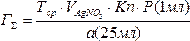 Теоретический расчет суммы натрия хлорида и кислоты хлороводородной в 1мл раствора глюкозы. Стабилизатор Вейбеля: Натрия хлорид 5,2 г Кислоты хлороводородной разведенной 4,4 мл Воды для инъекций до 1 л В 1 литр стабилизатора содержится 9,6 г суммы NaCl и HCl разв. На 1 литр раствора глюкозы добавлено 50 мл стабилизатора (5%): В 1000 мл — 9,6 г суммы NaCl и HCl разв. В 50 мл — х г суммы NaCl и HCl разв. х=0,48 г суммы NaCl и HCl разв. в 1 л раствора глюкозы; 0,00048 г суммы NaCl и HCl разв. в 1 мл расвора глюкозы. Расчет среднего титра натрия хлорида и кислоты хлороводородной разведенной. Теоретический расчет суммы натрия хлорида и кислоты хлороводородной в 1мл раствора глюкозы. Стабилизатор Вейбеля: Натрия хлорид 5,2 г Кислоты хлороводородной разведенной 4,4 мл Воды для инъекций до 1 л В 1 литр стабилизатора содержится 9,6 г суммы NaCl и HCl разв. На 1 литр раствора глюкозы добавлено 50 мл стабилизатора (5%): В 1000 мл — 9,6 г суммы NaCl и HCl разв. В 50 мл — х г суммы NaCl и HCl разв. х=0,48 г суммы NaCl и HCl разв. в 1 л раствора глюкозы; 0,00048 г суммы NaCl и HCl разв. в 1 мл расвора глюкозы. Расчет среднего титра натрия хлорида и кислоты хлороводородной разведенной.  — 0,005844 г/мл — 0,005844 г/мл  — 0,003646 г/мл — 0,003646 г/мл 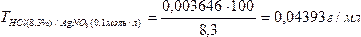 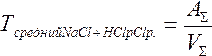 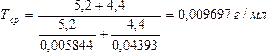 Пропись 3 Раствор Рингера Состав: Натрия хлорида 9 г Калия хлорида 0,2 г Кальция хлорида 0,2 г Натрия гидрокарбоната 0,2 г Воды для инъекций до 1 л Определение подлинности: Натрий - ион. Графитовую палочку, смоченную раствором, вносят в бесцветное пламя горелки, пламя окрашивается в желтый цвет. Хлорид - ион. К 3-5 кап. раствора прибавляют по 3-5 кап. разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака. Калий - ион. К 2 мл раствора прибавляют 0,5 мл уксусной кислоты, 0,5 мл натрия кобальтинитрита. Образуется желтый кристаллический осадок Гидрокарбонат - ион. 1). К 2 мл раствора прибавляют 0,5 мл разведенной соляной кислоты. Выделяются пузырьки углекислого газа. 2). К 2 мл раствора прибавляют 5 кап. насыщенного раствора магния сульфата. Белый осадок образуется только при кипячении (гидрокарбонат - ион). Кальций - ион. К 3 мл раствора прибавляют 1 кап. оксалата аммония. Образуется белый осадок, растворимый в разведенных минеральных кислотах и нерастворимый в уксусной кислоте и растворе аммиака Количественное определение: Натрия гидрокарбонат. К 5 мл раствора прибавляют 1 кап. раствора метилового красного и титруют 0,02 н. раствора соляной кислоты до красного окрашивания.1 мл 0,02 н. раствора соляной кислоты соответствует 0,00168 г натрия гидрокарбоната. Кальция хлорид. К 10 мл раствора прибавляют 1 мл аммиачного буферного раствора, 0,02-0,05 г индикаторной смеси кислотного хром темно - синего и титруют 0,01 М раствором трилона Б до сине - фиолетового окрашивания.1 мл 0,01 М раствора трилона Б соответствует 0,00219 г кальция хлорида Натрия хлорид, калия хлорид и кальция хлорид. К 0,5 мл раствора прибавляют 1 кап. раствора хромата калия и титруют 0,1 н. раствором серебра нитрата до оранжево - желтого окрашивания.1 мл 0,1 н. раствора серебра нитрата соответствует 0,00596 г суммы хлоридов натрия, калия и кальция. Пропись 3 Раствор Рингера Состав: Натрия хлорида 9 г Калия хлорида 0,2 г Кальция хлорида 0,2 г Натрия гидрокарбоната 0,2 г Воды для инъекций до 1 л Определение подлинности: Натрий - ион. Графитовую палочку, смоченную раствором, вносят в бесцветное пламя горелки, пламя окрашивается в желтый цвет. Хлорид - ион. К 3-5 кап. раствора прибавляют по 3-5 кап. разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака. Калий - ион. К 2 мл раствора прибавляют 0,5 мл уксусной кислоты, 0,5 мл натрия кобальтинитрита. Образуется желтый кристаллический осадок Гидрокарбонат - ион. 1). К 2 мл раствора прибавляют 0,5 мл разведенной соляной кислоты. Выделяются пузырьки углекислого газа. 2). К 2 мл раствора прибавляют 5 кап. насыщенного раствора магния сульфата. Белый осадок образуется только при кипячении (гидрокарбонат - ион). Кальций - ион. К 3 мл раствора прибавляют 1 кап. оксалата аммония. Образуется белый осадок, растворимый в разведенных минеральных кислотах и нерастворимый в уксусной кислоте и растворе аммиака Количественное определение: Натрия гидрокарбонат. К 5 мл раствора прибавляют 1 кап. раствора метилового красного и титруют 0,02 н. раствора соляной кислоты до красного окрашивания.1 мл 0,02 н. раствора соляной кислоты соответствует 0,00168 г натрия гидрокарбоната. Кальция хлорид. К 10 мл раствора прибавляют 1 мл аммиачного буферного раствора, 0,02-0,05 г индикаторной смеси кислотного хром темно - синего и титруют 0,01 М раствором трилона Б до сине - фиолетового окрашивания.1 мл 0,01 М раствора трилона Б соответствует 0,00219 г кальция хлорида Натрия хлорид, калия хлорид и кальция хлорид. К 0,5 мл раствора прибавляют 1 кап. раствора хромата калия и титруют 0,1 н. раствором серебра нитрата до оранжево - желтого окрашивания.1 мл 0,1 н. раствора серебра нитрата соответствует 0,00596 г суммы хлоридов натрия, калия и кальция. |
||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 24.03. | Внутриаптечная заготовка Пропись 1. Раствор новокаина 0, 25%, 0,5%, 1% и 2% Состав: Новокаина 2,5 г, 5 г, 10 г или 20 г Раствора соляной кислоты 0,1 н. соответственно: 3 мл, 4 мл, 9 мл или 12 мл Воды для инъекций до 1 л Описание:Прозрачная бесцветная жидкостьОпределение подлинности: Новокаин. 1) К 3-5 кап. раствора прибавляют по 2-3 кап. разведенной соляной кислоты и щелочного раствора бета - нафтола - 3 ч. и натрия нитрита 10% - 1 ч. образуется оранжево - красный осадок. 2) К 0,5 мл раствора прибавляют 2-3 кап. разведенной серной кислоты и 2-3 кап. 0,1 н. раствора калия перманганата. Фиолетовая окраска исчезает. Хлорид - ион. К 3-5 кап. раствора прибавляют по 3-5 кап. разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака. Количественное определение: Новокаин. К 2 мл 0,25%, 0,5% или 1 мл 1% раствора прибавляют 2-3 мл воды, 1 мл разведенной соляной кислоты, 0,2 г бромида калия, 2 кап. раствора тропеолина 00,1 кап. раствора метиленового синего и титруют при 18-20 град. 0,02 М (0,25% и 0,5%) или 0,1 М (1% и 2%) раствором натрия нитрита, добавляя его в начале 0,2-0,3 мл через 1 мин., а в конце титрования (за 0,1-0,2 мл до эквивалентного количества) по 1-2 кап. через 1 мин. до перехода красно - фиолетовой окраски в голубую. При титровании 0,02 М раствором натрия нитрита параллельно проводят контрольный опыт. 1 мл 0,02 М раствора натрия нитрита соответствует 0,005456 г, а 0,1 М - 0,02728 г новокаина. Кислота соляная 0,1 н. 5 мл раствора титруют 0,01 н. раствором едкого натра до желтого окрашивания (индикатор - метиловый - красный). 1 мл 0,01 н. раствора едкого натра соответствует 0,0003646 г хлристого водорода. Содержание 0,1 н. раствора соляной кислоты в мл (Х) вычисляют по формуле: А х 0,0003646 х 100 х 100 Х = -------------------------, 5 х 0,3646 где: А - количество 0,01 н. раствора едкого натра, мл, 0,3646 - количество хлористого водорода в 100 мл 0,1 н. раствора соляной кислоты, г. Пропись 2 Раствор фурацилина 0,02% Состав: Фурацилина 0,2 г Воды для инъекций до 1 л Описание:Прозрачная жидкость желтого цвета Определение подлинности: Фурацилин. К 1 мл раствора прибавляют 1 кап. раствора едкого натра. Появляется оранжевое окрашивание. Количественное определение. Фурацилин. В колбу с притертой пробкой емкостью 50 мл помещают 5 мл 0,01 н. раствора йода, прибавляют 0,1 мл раствора едкого натра и 5 мл испытуемого раствора. Через 1-2 мин. к раствору прибавляют 2 мл разведенной серной кислоты. Выделившийся йод титруют 0,01 н. раствором натрия тиосульфата (индикатор - крахмал). Параллельно проводят контрольны опыт. 1 мл 0,01 н. раствора йода соответствует 0,0004954 г фурацилина. Пропись 3 Калий йодид 20 % Описание:Прозрачная бесцветная жидкостьОпределение подлинности К 4—5 каплям раствора прибавляют 4—5 капель воды, по 2—3 капли разведенной уксусной кислоты и раствора кобальтинитрита натрия. Образуется желтый кристаллический осадок. К 2—3 каплям раствора прибавляют по 2—3 капли воды и разведенной соляной кислоты, 3—5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформныйслой окрашивается в фиолетовый цвет Количественное определение К 10 мл разведенного раствора (5:100) прибавляют0,5 мл разведенной уксусной кислоты, 3—5 капель 0,1% Раствора натрия эозината и титруют 0,1 моль/л раствором серебра нитрата до ярко-розово го окрашивания осадка. 1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,0166 г калия йодида | ||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 25.03. | Концентраты Пропись 1. Натрия бензоат 10% Плотность1,0381 Прозрачность и цветность раствора.Раствор 1 г препарата в 10 мл свежепрокипяченной и охлажденной воды должен быть прозрачным а бесцветным. Щелочность и кислотность.К полученному раствору прибавляют несколько капель раствора фенолфталеина; раствор должен оставаться' бесцветным. Розовая окраска должна появиться от прибавления не более 0,75 мл 0,05 н. раствора едкого натра. Хлориды. 0,15г препарата растворяют в 14 мл воды, прибавляют 1 мл разведенной азотной кислоты и фильтруют. 10 мл фильтрата должны выдерживать испытание на хлориды (не более 0,02% в препарате). Сульфаты. 1,5 г препарата растворяют в 25 мл воды, прибавляют 5 мл разведенной соляной кислоты и фильтруют. 10 мл фильтрата должны выдерживать испытание на сульфаты (не более 0,02% в препарате). Тяжелые металлы. 10мл того же фильтрата должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Потеря в весе при высушивании.Около 0,5 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 3%. Подлинность К 2—3 каплям раствора прибавляют 0,5—1 мл воды н 1—2 капли раствора окисного железа хлорида. Образуется розовато-желтый осадок. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет Количественное определение К 10 мл разведенного раствора (10:100)) прибавляют20 мл эфира, 2 капли раствора метилового оранжевого и1 каплю раствора метиленово-го синего, титруют 0,1 моль/лраствором соляной кислотыпри взбалтывании до фиолетового окрашивания водногослоя, сходного с таковым в контрольном опыте. 1 мл 0,1 моль/л раствора соляной кислоты соответствует 0,0144 г натрия бензоата Пропись 2. Натрия бромид 20% Плотность1,1488 Прозрачность и цветность раствора. Раствор препарата (1 : 10) должен быть прозрачным и бесцветным Щелочность. 1 г препарата растворяют в 10 мл свежепрокипяченной « охлажденной воды, прибавляют 0,1 мл 0,1 н. раствора соляной кислоты; раствор не должен окрашиваться в розовый цвет ни на холоду, ни при кипячении от прибавления 1 капли раствора фенолфталеина. Подлинность К 3—4 каплям раствора прибавляют по 2—3 капли воды и разведенной соляной кислоты, 3—5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет Количественное определение Титруют 5 мл разведенного раствора (5:100) ОД моль/л раствором серебра нитрата до оранжево-желтого окрашивания (индикатор — хромат калия). 1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,01029 г натрия бромида Пропись 3. Натрия гидрокарбонат 5 % Плотность 1,0331 Состав 50 г натрия гидрокарбоната До 1 л воды для инъекций Подлинность К 4—5 каплям раствора прибавляют 2—3 капли разведенной соляной кислоты. Выделяются пузырьки угольного ангидрида. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет Количественное определение Титруют 10 мл разведенного раствора (10:100) 0,1 моль/л с раствором соляной кислоты до розового окрашивания (индикатор — метиловый оранжевый). 1 мл 0,1 моль/л раствора соляной кислоты соответствует 0,0084 г натрия гидрокарбоната | ||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 28.03. | Концентраты Пропись 1. Натрия салицилат 10% Плотость1,0301 Прозрачность и цветность раствора.Раствор 2 г препарата в 50 мл свежепрокипяченной и охлажденной воды должен быть прозрачным и бесцветным. Щелочность или кислотность.К полученному раствору прибавляют несколько капель фенолфталеина. Раствор должен оставаться бесцветным. Розовая окраска должна появиться от прибавления не более 0,4 мл 0,05 н. раствора едкого натра. Подлинность К 2—3 каплям раствора прибавляют 1—2 мл воды и 2—3 капли раствора окисного железа хлорида. Появляется фиолетовое окрашивание. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет Количественное определение К 10 мл разведенного раствора (10:100) прибавляют 2 каплн раствора метилового оранжевого и 1 каплю раствора метиленового синего, 20 мл эфира и титруют0,1 моль/л раствором солянойкислоты при взбалтывании до фиолетового окрашивания водного слоя, сходного с таковым в контрольном опыте 1 мл 0,1 моль/л раствора соляной кислоты соответствует 0,01601 гнатрия салнцилата. Пропись 2 Натрия тио сульфат 60 % Na2S203 * 5H2O Прозрачная жидкость. Допускаются беловатый, желтоватый или слабо-розовый оттенок. Плотность 1,2734 Подлинность К 3—4 Каплям раствора прибавляют 1—2 мл воды и 3—4 капли разведенной соляной кислоты. Постепенно раствор мутнеет и выделяется сернистый ангидрид, обнаруживаемый по запаху. К 3—4каплям раствора прибавляют по 1—2 мл воды ираствора нитрата серебра. Образуется белый осадок, быстро переходящий в желтый, бурый и черный. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается вжелтый цвет Количественное определение К 5 мл разведенного раствора (5:100) прибавляют 5 мл воды и титруют 0,1 моль/л раствором йода (индикатор — крахмал). I мл 0,1 моль/л растворайода соответствует 0,02482 гнатрия тиосульфата Пропись 3 Хл ор а л гидр ат 10 %CCl3CH(ОН)2 Водные растворы хлоралгидрата нейтральны, разлагаются с образованием трихлоруксуснон кислоты. При нагревании разложение ускоряется. Гигроскопичен при повышенной влажности. На воздухе медленно улетучивается. Подлинность К 0,5 мл раствора прибавляют 1 мл раствора натрия гид-роксида и взбалтывают. Выделяется хлороформ, обнаруживаемый по запаху. Затем добавляют несколько кристаллов резорцина и нагревают. Появляется розовое окрашивание Количественное определение К 10 мл разведенного раствора (10:100) прибавляют 5, 12мл 0,1моль/л раствора натрия гидроксида, перемешивают и через 2 мин избыток натрия гидроксида оттитровы-вают 0,1моль/л раствором со-лнной кислоты (индикатор — фенолфталеин). Параллельно проводят контрольный опыт. 1мл 0,1 моль/лраствора натрия гидроксида соответствует 0,01654 г хлоралгидрата | ||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 29.03. | Анализ лекарственных веществ Anaesthesinum 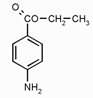 Анестезин Aethylis Aminobenzoas * (Аnaesthesinum). Этиловый эфир пара-аминобензойной кислоты.M. в. 165,19 Описание. Белый кристаллический порошок без запаха, слабо горького вкуса. Вызывает на языке чувство онемения. Растворимость. Очень мало растворим в воде, легко растворим в спирте, эфире, хлороформе, трудно растворим в жирных маслах и разведенной соляной кислоте. Подлинность. Препарат дает характерную реакцию на ароматические первичные амины 0,05 г препарата растворяют в 2 мл воды, подкисленной 3 каплями разведенной соляной кислоты, прибавляют 3 капли 0,1 мол раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора р-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. 0,05 г препарата нагревают с 5 мл раствора едкого натра и приливают 0,1 н. раствор йода до неисчезающего желтого окрашивания; появляется запах йодоформа. 0,05 г препарата растворяют в 2 мл воды с 5 каплями разведенной соляной кислоты и прибавляют 2 мл раствора хлорамина. Через 2—3 минуты добавляют 2 мл эфира и взбалтывают; эфирный слой окрашивается в оранжевый цвет. Температура плавления 89—91,5°. Прозрачность и цветность раствора. Раствор 1 г препарата в 10 мл нейтрализованного по фенолфталеину спирта должен быть прозрачным и бесцветным. Кислотность. К полученному раствору прибавляют 3 капли раствора фенолфталеина. Розовое окрашивание должно появиться от прибавления не более 0,1 мл 0,05 н. раствора едкого натра. Хлориды. Раствор 1 г препарата в 10 мл спирта должен выдерживать испытание на хлориды (не более 0,002% в препарате). Органические примеси. 0,5 г препарата растворяют в 5 мл концентрированной серной кислоты. Окраска полученного раствора не должна быть интенсивнее эталона № 5а. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,2 г препарата (точная навеска) растворяют в 10 мл воды и 10 мл разведенной соляной кислоты Титрование проводят при температуре не выше 18—20°, однако в некоторых случаях требуется охлаждение до 0—10°. Точку эквивалентности определяют с помощью внутренних индикаторов, внешних индикаторов (йодкрахмальная бумага, флавакридин и др.) или электрометрическими методами (потенциометрическое титрование, титрование «до полной остановки»). В качестве внутренних индикаторов используют тропеолин 00 (4 капли раствора), тропеолин 00 в смеси с метиленовым синим (4 капли раствора тропеолина 00 и 2 капли раствора метиленового синего), нейтральный красный (2 капли 0,5% раствора в начале и 2 капли в конце титрования) и др. Титрование с тропеолином 00 ведут до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим — от красно-фиолетовой к голубой, с нейтральным красным — от малиновой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 минут. Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 минуту после прибавления раствора нитрита натрия, не будет немедленно вызывать синее окрашивание на бумаге. Параллельно проводят контрольный опыт. При потенциометрическом титровании в качестве индикаторного электрода применяют платиновый электрод, электродом сравнения служит насыщенный каломельный электрод. . В случае применения внутренних индикаторов используют нейтральный красный или тропеолин 00 в смеси с метиленовым синим. 1 мл 0,1 мол раствора нитрита натрия соответствует 0,01652 г C9H11NO2, которого в препарате должно быть не менее 99,5%. Хранение. Список Б. В хорошо укупоренной таре, предохраняющей от действия света. Высшая разовая доза внутрь 0,5 г. Высшая суточная доза внутрь 1,5 г. Местноанестезирующее средство. РезерпинReserpinum Анестезин Aethylis Aminobenzoas * (Аnaesthesinum). Этиловый эфир пара-аминобензойной кислоты.M. в. 165,19 Описание. Белый кристаллический порошок без запаха, слабо горького вкуса. Вызывает на языке чувство онемения. Растворимость. Очень мало растворим в воде, легко растворим в спирте, эфире, хлороформе, трудно растворим в жирных маслах и разведенной соляной кислоте. Подлинность. Препарат дает характерную реакцию на ароматические первичные амины 0,05 г препарата растворяют в 2 мл воды, подкисленной 3 каплями разведенной соляной кислоты, прибавляют 3 капли 0,1 мол раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора р-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. 0,05 г препарата нагревают с 5 мл раствора едкого натра и приливают 0,1 н. раствор йода до неисчезающего желтого окрашивания; появляется запах йодоформа. 0,05 г препарата растворяют в 2 мл воды с 5 каплями разведенной соляной кислоты и прибавляют 2 мл раствора хлорамина. Через 2—3 минуты добавляют 2 мл эфира и взбалтывают; эфирный слой окрашивается в оранжевый цвет. Температура плавления 89—91,5°. Прозрачность и цветность раствора. Раствор 1 г препарата в 10 мл нейтрализованного по фенолфталеину спирта должен быть прозрачным и бесцветным. Кислотность. К полученному раствору прибавляют 3 капли раствора фенолфталеина. Розовое окрашивание должно появиться от прибавления не более 0,1 мл 0,05 н. раствора едкого натра. Хлориды. Раствор 1 г препарата в 10 мл спирта должен выдерживать испытание на хлориды (не более 0,002% в препарате). Органические примеси. 0,5 г препарата растворяют в 5 мл концентрированной серной кислоты. Окраска полученного раствора не должна быть интенсивнее эталона № 5а. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,2 г препарата (точная навеска) растворяют в 10 мл воды и 10 мл разведенной соляной кислоты Титрование проводят при температуре не выше 18—20°, однако в некоторых случаях требуется охлаждение до 0—10°. Точку эквивалентности определяют с помощью внутренних индикаторов, внешних индикаторов (йодкрахмальная бумага, флавакридин и др.) или электрометрическими методами (потенциометрическое титрование, титрование «до полной остановки»). В качестве внутренних индикаторов используют тропеолин 00 (4 капли раствора), тропеолин 00 в смеси с метиленовым синим (4 капли раствора тропеолина 00 и 2 капли раствора метиленового синего), нейтральный красный (2 капли 0,5% раствора в начале и 2 капли в конце титрования) и др. Титрование с тропеолином 00 ведут до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим — от красно-фиолетовой к голубой, с нейтральным красным — от малиновой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 минут. Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 минуту после прибавления раствора нитрита натрия, не будет немедленно вызывать синее окрашивание на бумаге. Параллельно проводят контрольный опыт. При потенциометрическом титровании в качестве индикаторного электрода применяют платиновый электрод, электродом сравнения служит насыщенный каломельный электрод. . В случае применения внутренних индикаторов используют нейтральный красный или тропеолин 00 в смеси с метиленовым синим. 1 мл 0,1 мол раствора нитрита натрия соответствует 0,01652 г C9H11NO2, которого в препарате должно быть не менее 99,5%. Хранение. Список Б. В хорошо укупоренной таре, предохраняющей от действия света. Высшая разовая доза внутрь 0,5 г. Высшая суточная доза внутрь 1,5 г. Местноанестезирующее средство. РезерпинReserpinum 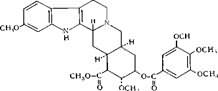 11,17-диметокси-15-карбометокси-18(3',4',5'-триметоксибеноилокси)-аллойохимбан. или 3, 4, 5-Триметоксибензоат метилрезерпата. М. в. 608,7 Описание. Белый или желтоватый мелкокристаллический порошок. Растворимость. Очень мало растворим в воде, 95% спирте и эфире, легко растворим в хлороформе и уксусной кислоте. Подлинность. К 1 мг препарата прибавляют 0,2 мл раствора ванилина в соляной кислоте; в течение 2 минут появляется розовое окрашивание. 1 мг препарата растворяют в 2 мл 95% спирта, прибавляют 1 мл 0,5 н. раствора серной кислоты и 0,5 мл 0,1 мол раствора нитрита натрия; через 1—2 минуты появляется зеленая флюоресценция. Удельное вращение от —113° до —122° (1% раствор в хлороформе). Оптическая плотность. 0,002% раствор препарата в 95% спирте имеет максимум поглощения при длине волны 268 нм; оптическая плотность этого раствора в кювете с толщиной слоя 1 см при длине волны 268 нм •около 0,55; в интервале длин волн от 288 нм до 295 нм около 0,34. Потеря в весе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 1%. Сульфатная зола из 0,2 г препарата должна быть невесомой. Количественное определение. Около 0,3 г препарата (точная навеска) растворяют в 10 мл безводной уксусной кислоты и титруют 0,1 н. раствором хлорной кислоты до зеленого окрашивания (индикатор — кристаллический фиолетовый). 1 мл 0,1 н раствора хлорной кислоты соответствует 0,06087 г 'C33H40N2O9, которого в пересчете на сухое вещество должно быть не менее 98,5% и не более 101,0%- Хранение. Список А. В хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Высшая разовая доза внутрь 0,002 г. Высшая суточная доза внутрь 0,01 г. .Нейролептическое, гипотензивное средство. Анальгин 1-Фенил-2,3-диметил-4-метиламинопиразолон-5-1М-метансульфат Натрия 11,17-диметокси-15-карбометокси-18(3',4',5'-триметоксибеноилокси)-аллойохимбан. или 3, 4, 5-Триметоксибензоат метилрезерпата. М. в. 608,7 Описание. Белый или желтоватый мелкокристаллический порошок. Растворимость. Очень мало растворим в воде, 95% спирте и эфире, легко растворим в хлороформе и уксусной кислоте. Подлинность. К 1 мг препарата прибавляют 0,2 мл раствора ванилина в соляной кислоте; в течение 2 минут появляется розовое окрашивание. 1 мг препарата растворяют в 2 мл 95% спирта, прибавляют 1 мл 0,5 н. раствора серной кислоты и 0,5 мл 0,1 мол раствора нитрита натрия; через 1—2 минуты появляется зеленая флюоресценция. Удельное вращение от —113° до —122° (1% раствор в хлороформе). Оптическая плотность. 0,002% раствор препарата в 95% спирте имеет максимум поглощения при длине волны 268 нм; оптическая плотность этого раствора в кювете с толщиной слоя 1 см при длине волны 268 нм •около 0,55; в интервале длин волн от 288 нм до 295 нм около 0,34. Потеря в весе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 1%. Сульфатная зола из 0,2 г препарата должна быть невесомой. Количественное определение. Около 0,3 г препарата (точная навеска) растворяют в 10 мл безводной уксусной кислоты и титруют 0,1 н. раствором хлорной кислоты до зеленого окрашивания (индикатор — кристаллический фиолетовый). 1 мл 0,1 н раствора хлорной кислоты соответствует 0,06087 г 'C33H40N2O9, которого в пересчете на сухое вещество должно быть не менее 98,5% и не более 101,0%- Хранение. Список А. В хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Высшая разовая доза внутрь 0,002 г. Высшая суточная доза внутрь 0,01 г. .Нейролептическое, гипотензивное средство. Анальгин 1-Фенил-2,3-диметил-4-метиламинопиразолон-5-1М-метансульфат Натрия 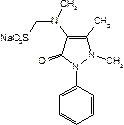 C13H,6N3Na04S • Н20 М. в. 351,3 Описание. Белый или белый с едва заметным желтоватым оттенком крупноигольчатый, кристаллический порошок без запаха, горьковатого вкуса. В присутствии влаги быстро разлагается. Водные растворы при< стоянии желтеют. Растворимость. Растворим в 1,5 ч. воды, 160 ч. 95% спирта, практически нерастворим в эфире, хлороформе и ацетоне. Подлинность. 0,1 г препарата смачивают 2 каплями воды, прибавляют 5 мл 95% спирта и 0,5 мл разведенной соляной кислоты. После-растворения препарата прибавляют 5 мл 0,1 н. раствора йодата калия; раствор окрашивается в малиновый цвет, при дальнейшем добавлении реактива окраска усиливается и выделяется бурый осадок. 0,2 г препарата нагревают с 2 мл разведенной соляной кислоты; сначала ощущается острый запах сернистого ангидрида, а затем формальдегида. Препарат дает характерную реакцию Б на натрий. Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет,. Прозрачность раствора. 5% водный раствор должен быть прозрачным. Кислотность или щелочность. 0,1 г препарата растворяют в 10 мл свежепрокипяченной и охлажденной воды. Полученный раствор должен-давать зеленую окраску с раствором бромтимолового синего. Если появляется синяя окраска, то она должна исчезать от прибавления не более 0,05 мл 0,01 н. раствора соляной кислоты. Аминоантипирин. 0,2 г препарата смачивают в пробирке 2—3 каплями воды, прибавляют 3 мл спирта, перемешивают до растворения и прибавляют последовательно при перемешивании по 1 капле раствора аммиака, раствора феррицианида калия и жидкого фенола. Смесь разводят 5 мл воды; раствор должен быть светло-зеленым и не должен приобретать оранжевый и розовый оттенок. Потеря в весе при высушивании. Около 0,25 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 5,5%. Тяжелые металлы. Сульфатная зола из 0,25 г препарата должна выдерживать испытание на тяжелые металлы (не более 0,002% в препарате). Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001 % в препарате). Количественное определение. Около 0,2 г препарата (точная навеска) помещают в сухую колбу, прибавляют 20 мл спирта, 5 мл 0,01 н. раствора соляной кислоты, перемешивают до растворения и титруют 0,1 н. раствором йода до появления желтой окраски раствора, неисчезающей в течение 30 секунд. 1 мл 0,1 н. раствора йода соответствует 0,01667 г Ci3Hi6N3Na04S, которого в пересчете на сухое вещество должно быть не менее 99,0%. Хранение. Список Б. В хорошо укупоренных банках оранжевого. стекла, в защищенном от света месте. Высшая разовая доза внутрь 1,0 г. Высшая суточная доза внутрь 3,0 г. Высшая разовая доза под кожу, внутримышечно, в вену 0,5 г. Высшая суточная доза под кожу, внутримышечно, в вену 1,5 г. Болеутоляющее, жаропонижающее, противовоспалительное средство, C13H,6N3Na04S • Н20 М. в. 351,3 Описание. Белый или белый с едва заметным желтоватым оттенком крупноигольчатый, кристаллический порошок без запаха, горьковатого вкуса. В присутствии влаги быстро разлагается. Водные растворы при< стоянии желтеют. Растворимость. Растворим в 1,5 ч. воды, 160 ч. 95% спирта, практически нерастворим в эфире, хлороформе и ацетоне. Подлинность. 0,1 г препарата смачивают 2 каплями воды, прибавляют 5 мл 95% спирта и 0,5 мл разведенной соляной кислоты. После-растворения препарата прибавляют 5 мл 0,1 н. раствора йодата калия; раствор окрашивается в малиновый цвет, при дальнейшем добавлении реактива окраска усиливается и выделяется бурый осадок. 0,2 г препарата нагревают с 2 мл разведенной соляной кислоты; сначала ощущается острый запах сернистого ангидрида, а затем формальдегида. Препарат дает характерную реакцию Б на натрий. Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет,. Прозрачность раствора. 5% водный раствор должен быть прозрачным. Кислотность или щелочность. 0,1 г препарата растворяют в 10 мл свежепрокипяченной и охлажденной воды. Полученный раствор должен-давать зеленую окраску с раствором бромтимолового синего. Если появляется синяя окраска, то она должна исчезать от прибавления не более 0,05 мл 0,01 н. раствора соляной кислоты. Аминоантипирин. 0,2 г препарата смачивают в пробирке 2—3 каплями воды, прибавляют 3 мл спирта, перемешивают до растворения и прибавляют последовательно при перемешивании по 1 капле раствора аммиака, раствора феррицианида калия и жидкого фенола. Смесь разводят 5 мл воды; раствор должен быть светло-зеленым и не должен приобретать оранжевый и розовый оттенок. Потеря в весе при высушивании. Около 0,25 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 5,5%. Тяжелые металлы. Сульфатная зола из 0,25 г препарата должна выдерживать испытание на тяжелые металлы (не более 0,002% в препарате). Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001 % в препарате). Количественное определение. Около 0,2 г препарата (точная навеска) помещают в сухую колбу, прибавляют 20 мл спирта, 5 мл 0,01 н. раствора соляной кислоты, перемешивают до растворения и титруют 0,1 н. раствором йода до появления желтой окраски раствора, неисчезающей в течение 30 секунд. 1 мл 0,1 н. раствора йода соответствует 0,01667 г Ci3Hi6N3Na04S, которого в пересчете на сухое вещество должно быть не менее 99,0%. Хранение. Список Б. В хорошо укупоренных банках оранжевого. стекла, в защищенном от света месте. Высшая разовая доза внутрь 1,0 г. Высшая суточная доза внутрь 3,0 г. Высшая разовая доза под кожу, внутримышечно, в вену 0,5 г. Высшая суточная доза под кожу, внутримышечно, в вену 1,5 г. Болеутоляющее, жаропонижающее, противовоспалительное средство, |
||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 30.03. | Анализ лекарственных веществ Aluminii hydroxydum Алюминия гидроокись Aluminium hydroxydatum А1(ОН)3 М. в. 78,00 Описание. Белый рыхлый аморфный порошок. Растворимость. Практически нерастворим в воде, растворим при нагревании в разведенных кислотах и растворах едких щелочей с образованием прозрачного или слабо мутного раствора. Подлинность. При прокаливании препарата, предварительно смоченного раствором нитрата кобальта, получается остаток, окрашенный в синий цвет. Карбонаты. К 0,2 г препарата добавляют 10 мл воды, нагревают до кипения и фильтруют. От прибавления к фильтрату 2 капель раствора фенолфталеина может появиться розовое окрашивание, которое должно исчезнуть от прибавления не более 0,1 мл 0,1 н. раствора соляной кислоты. Хлориды. К 0,4 г препарата прибавляют 50 мл воды и азотной кислоты до растворения препарата, доводят водой до 100 мл и фильтруют. 10 мл фильтрата должны выдерживать испытание на хлориды (не более 0,05% в препарате). Сульфаты. 1 г препарата растворяют при нагревании в 30 мл разведенной соляной кислоты, по охлаждении доводят водой до 50 мл и фильтруют. 10 мл фильтрата должны выдерживать испытание на сульфаты (не более 0,05% в препарате). Железо. 5 мл того же фильтрата, разбавленные водой до 10 мл, должны выдерживать испытание на железо (не более 0,03% в препарате). Аммиак. 10 мл того же фильтрата должны выдерживать испытание на аммиак (не более 0,01% в препарате). Тяжелые металлы. 0,5 г препарата растворяют при нагревании в 5 мл уксусной кислоты, разбавляют водой до 10 мл и фильтруют. Полученный раствор должен выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001% в препарате). Хранение. В хорошо укупоренной таре. Антацидное средство. Argenti nitras Серебра нитрат Argentum nitricum AgN03 М. в. 169,87 Описание. Бесцветные прозрачные кристаллы в виде пластинок ил» белых цилиндрических палочек, без запаха. Под действием света препарат темнеет. Растворимость. Очень легко растворим в воде, трудно растворим в спирте. Подлинность. 0,05 г препарата дают характерные реакции на серебро-и реакцию А на нитраты (К препарату (около 0,001 г иона нитрата) прибавляют несколько капель раствора дифениламина появляется синее окрашивание). Серебро А. К 1 мл раствора соли серебра (около 0,005 г иона серебра) прибавляют 2—3 капли разведенной соляной кислоты или раствора хлорида натрия; образуется белый творожистый осадок, нерастворимый в азотной кислоте, растворимый в растворе аммиака. Б. К 1 мл раствора соли серебра (около 0,005 г иона серебра) прибавляют раствор аммиака до растворения образующегося вначале осадка, затем прибавляют 2—3 капли раствора формальдегида и нагревают; на стенках пробирки образуется блестящий налет металлического серебра. Кислотность. 1 г препарата растворяют в 10 мл воды и прибавляют I каплю раствора метилового красного; появляется розовое окрашивание, переходящее в желтое от прибавления не более 0,1 мл 0,05 н. раствора едкого натра. Висмут, медь, свинец. К 10 мл раствора препарата (1 : 10) прибавляют 5 мл раствора аммиака. Полученный раствор должен быть бесцветным и прозрачным. Количественное определение. Около 0,3 г препарата (точная навеска) растворяют в 50 мл воды, прибавляют 5 мл разведенной азотной кислоты и титруют 0,1 н. раствором роданида аммония (индикатор — железоаммониевые квасцы). 1 мл 0,1 н. раствора роданида аммония соответствует 0,01699 г AgN03, которого в препарате должно быть не менее 99,75%. Хранение. Список А. В хорошо укупоренных банках с притертой пробкой, в защищенном от света месте. Высшая разовая доза внутрь 0,03 г. Высшая суточная доза внутрь 0,1 г. Антисептическое и прижигающее средство; применяют наружно, иногда внутрь. . Bismuthi subnitras Висмута нитрат основной Bismuthutn subnitricum Описание.Белый аморфный или микрокристаллический порошок. Препарат, смоченный водой, окрашивает синюю лакмусовую бумагу в красный цвет. Растворимость. Практически нерастзорим в воде и спирте, легко растворим в азотной и соляной кислотах. Подлинность. 0,1 г препарата дает характерные реакции на Висмут А. Препараты висмута (около 0,05 г иона висмута) взбалтывают с 3 мл разведенной соляной кислоты и прибавляют 1 мл раствора сульфида натрия; появляется коричневато-черное окрашивание. 0,5 г препарата при прокаливании выделяют желто-бурые пары и дают остаток ярко-желтого цвета. Б. Препараты висмута (около 0,05 г иона висмута) взбалтывают с 5 мл разведенной серной кислоты и фильтруют. К фильтрату прибавляют 2 капли раствора йодида калия; выпадает черный осадок, растворимый в избытке реактива. Кислотность. 5 г препарата смешивают с 75 мл воды, оставляют на 24 часа и затем фильтруют через стеклянный фильтр № 3 или № 4, на который положена небольшим слоем бумажная масса (до 1 см). На титрование 50 мл прозрачного фильтрата должно расходоваться не более 1,5 мл 0,1 н. раствора едкого натра (индикатор — фенолфталеин). Хлориды. 0,4 г препарата растворяют в 5 мл азотной кислоты и доводят водой до 10 мл. 1 мл этого раствора, разведенный водой до 10 мл, должен выдерживать испытание на хлориды (не более 0,05% в препарате). Соли щелочных и щелочноземельных металлов. 0,5 г препарата растворяют в 20 мл разведенной соляной кислоты, разбавляют водой до появления слабой мути и нагревают раствор до кипения. Медленно пропускают сероводород до полного осаждения висмута и фильтруют. Фильтрат выпаривают досуха и остаток осторожно прокаливают до постоянного веса. Остаток не должен превышать 0,5%. Карбонаты. 1 г препарата должен растворяться в 3 мл азотной кислоты без выделения пузырьков газа. Соли аммония. 1 г препарата кипятят с 5 мл раствора едкого натра; не должен ощущаться запах аммиака. Медь. 3 г препарата растворяют при нагревании в 4 мл концентрированной азотной кислоты. Полученный раствор вливают в стакан, содержащий 100 мл воды, выпавший осадок отфильтровывают и промывают разведенной азотной кислотой (2 раза по 5 мл). Фильтрат вместе с промывной жидкостью упаривают до объема 30 мл и вторично фильтруют. К 5 мл этого фильтрата прибавляют небольшой избыток раствора аммиака; жидкость над осадком должна оставаться бесцветной. Свинец. К 5 мл того же фильтрата прибавляют 5 мл разведенной серной кислоты; не должна появляться муть. Серебро. К 5 мл того же фильтрата прибавляют 10 капель разведен-«ой соляной кислоты; допускается опалесценция, не превышающая опа-лесценцию 5 мл эталонного раствора. Примечание. Приготовление эталонного раствора. 1 мл 0,1 н. раствора нитрата серебра разводят водой в мерной колбе до 100 мл. 10 мл полученного раствора разводят водой в мерной колбе до 100 мл. 1 мл полученного раствора доводят водой до 5 мл. Сульфаты. К 5 мл того же фильтрата прибавляют 0,5 мл раствора нитрата бария; раствор должен быть прозрачным. Мышьяк, теллур. 1 г препарата прокаливают. Остаток растворяют в 5 мл соляной кислоты и далее поступают, как указано в статье «Испытание на мышьяк», метод 2. Не должно быть ни побурения (мышьяк),. ни почернения (теллур). Количественное определение. Около 0,1 г препарата (точная навеска) помещают в колбу емкостью 300 мл, растворяют в 3 мл горячей азотной кислоты, прибавляют 250 мл воды, 4—5 капель раствора ксиленолового оранжевого или 6—7 капель раствора пирокатехинового фиолетового и титруют при взбалтывании 0,05 мол раствором трилона Б до перехода красной или синей окраски в желтую. 1 мл 0,05 мол раствора трилона Б соответствует 0,01165 г В120з, которой в препарате должно быть не менее 79,0% и не более 82,0%. Хранение. В хорошо укупоренной таре, предохраняющей от действия» света. Вяжущее средство. | ||||
| дата | Характер и содержание выполненной работы | Подпись | |||
| 31.03. | Анализ лекарственных веществ Dibazolum Дибазол Bendazoli Hydrochloridum * 2-Бензилбензимидазола гидрохлори CuH12N2HCl M. в. 244,73 Описание. Белый или белый со слегка сероватым или желтоватым оттенком кристаллический порошок, горько-соленого вкуса. Гигроскопичен. Растворимость. Трудно растворим в воде и хлороформе, легко растворим в спирте, мало растворим в ацетоне, практически нерастворим в эфире. Подлинность. 0,02 г препарата растворяют в 5 мл воды, прибавляют 3 капли разведенной соляной кислоты, 2—3 капли 0,1 н. раствора йода и взбалтывают; образуется красновато-серебристый осадок. 0.02 г препарата растворяют в 3 мл воды, прибавляют 1 мл раствора аммиака и образующийся осадок отфильтровывают. Фильтрат, подкисленный 2,5 мл разведенной азотной кислоты дает характерную реакцию на хлориды (К 2 мл раствора хлорида (около 0,002 г иона хлорида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра; образуется белый творожистый осадок, растворимый в растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка хлорида серебра проводят после отфильтровывания ипромывания осадка водой). Температура плавления 182—186° (в пределах 3°). Фенилендиамин. 0,5 г препарата растворяют в 10 мл воды при нагревании до 90°, подкисляют 0,5 мл 1 н. раствора соляной кислоты, прибавляют 1 каплю I % раствора хлорида окисного железа; не должно появляться розовое окрашивание. Потеря в весе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 70—80° до постоянного веса. Потеря в весе не должна превышать 1,5%. Органические примеси. 0,3 г препарата растворяют в 5 мл концентрированной серной кислоты. Окраска полученного раствора не должна быть интенсивнее эталонов № 5а или № 4в. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0.5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,15 г препарата (точная навеска), предварительно высушенного при 70—80° до постоянного веса, растворяют в 10 мл безводной уксусной кислоты, прибавляют 5 мл раствора ацетата окисной ртути и титруют 0,1 н. раствором хлорной кислоты до голубовато-зеленого окрашивания (индикатор — кристаллический фиолетовый). Параллельно проводят контрольный опыт. I мл 0,1 н. раствора хлорной кислоты соответствует 0,02447 г CkHi2N2-HC1, которого в высушенном препарате должно быть не менее 99,0%. Хранение. Список Б. В хорошо укупоренной таре. Высшая разовая доза внутрь 0,05г. Высшая суточная доза внутрь 0,15г. Спазмолитическое, гипотензивное средство Calcii chloridum Кальция хлорид Calcium chloratum СаС12-6Н20 М. в. 219,08 Описание. Бесцветные кристаллы без запаха, горько-соленого вкуса. Препарат очень гигроскопичен, на воздухе расплывается. Растворимость. Очень легко растворим в воде, вызывая при этом сильное охлаждение раствора, легко растворим в 95% спирте. Подлинность. Препарат дает характерные реакции на кальций и хлориды (стр. 744; 747). Прозрачность и цветность раствора. Раствор 1 г препарата в 10 мл воды должен быть прозрачным и бесцветным. Вещества, нерастворимые в 95% спирте. 0,5 г препарата должны полностью растворяться в 5 мл 95% спирта, образуя прозрачный бесцветней раствор. Кислотность или щелочность. 1 г препарата растворяют в 20 мл све-жепрокипяченной и охлажденной воды, прибавляют 1 каплю раствора метилового красного. Окраска раствора должна изменяться от прибавления не более 0,05 мл 0,01 н. раствора едкого натра или соляной кислоты. Сульфаты. 4 г препарата растворяют в 20 мл воды. 10 мл полученного раствора должны выдерживать испытание на сульфаты (не более 0,005% в препарате). Тяжелые металлы. 5 мл того же раствора, разведенные водой до 10 мл, должны выдерживать испытание на тяжелые металлы (не более 0,0005% в препарате). Железо. Раствор 15 г препарата в \0 мл воды должен выдерживать испытание на железо (не более 0,0002% в препарате). Барий. 2 г препарата растворяют в 40 мл воды. К 10 мл полученного раствора прибавляют 5 мл насыщенного раствора сульфата кальция; в течение 1 часа в растворе не должна появляться муть. Железо, алюминий, фосфаты. К 10 мл того же раствора прибавляют 1 мл раствора хлорида аммония, 1 каплю раствора фенолфталеина и раствор аммиака до появления розового окрашивания; в полученном растворе ни при комнатной температуре, ни при кипячении не должна появляться муть. Соли магния и щелочных металлов. 20 мл того же раствора нагревают до кипения. К горячему раствору прибавляют 0,5 г хлорида аммония, раствора аммиака до щелочной реакции и 20 мл горячего раствора оксалата аммония. После охлаждения выпавший осадок отфильтровывают. К 20 мл фильтрата прибавляют 0,5 мл концентрированной серной кислоты и выпаривают до полного удаления аммонийных солей, остаток прокаливают до постоянного веса. Остаток не должен превышать 0,5%. Цинк. Раствор 1 г препарата в 10 мл воды не должен давать реакции на цинк. Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001% в препарате). Количественное определение. Около 0,8 г препарата (точная навеска), отвешенные в закрытом бюксе, растворяют в воде, переносят в мерную колбу емкостью 100 мл, доводят объем раствора водой до метки и тщательно перемешивают. К 25 мл приготовленного раствора прибавляют 5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси или 7 капель раствора кислотного хром темно-синего и титруют 0,05 мол раствором трилона Б до сине-фиолетового окрашивания. 1 мл 0,05 мол раствора трилона Б соответствует 0,01095 г СаОг ■ 6Н20, которого в препарате должно быть не менее 98,0%. Хранение. В небольших, хорошо укупоренных стеклянных банках с пробками, залитыми парафином, в сухом месте. Источник ионов кальция; антиаллергическое средство Diazolmum Диазолин Mebhydrolini Napadisylas *
3-Метил-9-бензил-1,2,3,4-тетрагидрокарболина нафталин-1,5-дисульфонат (C19H2oN2)2-C1oH806S2 M. в. 841,1 Описание. Белый или белый с кремовым оттенком кристаллический порошок. Растворимость. Практически нерастворим в воде, 95% спирте, ацетоне, бензоле Оч2ень мало растворим в разведенных минеральных кислотах. Растворим в концентрированной серной кислоте. Подлинность. 0,1 г препарата встряхивают в делительной воронке с 5 мл воды и 3 мл 0,5 н. раствора едкого натра. Добавляют 10 мл эфира и снова встряхивают. Эфирный слой отделяют, промывают 5 мл воды, сушат над безводным сульфатом натрия и эфир отгоняют. Температура плавления остатка после высушивания при 40° должна быть 93—97°. 0,01 г препарата растворяют в 2 мл концентрированной серной кислоты и прибавляют 0,01 г нитрита натрия; через 1—2 минуты появляется фиолетовое окрашивание. К 0,3 г препарата прибавляют 5 мл горячего раствора едкого натра, перемешивают и после охлаждения переносят в делительную воронку. Прибавляют 5 мл воды, 20 мл эфира и встряхивают до полного растворения выделившегося осадка. Эфирный слой отбрасывают. При постепенном добавлении к водному слою 1,5 г хлорида натрия выпадает осадок. Кислотность или щелочность. 1 г препарата взбалтывают с 20 мл воды и фильтруют через бумажную массу. К 5 мл полученного фильтрата прибавляют 2 капли раствора метилового красного; появившееся оранжевое или желтое окрашивание должно переходить в красное от прибавления не более 0,1 мл 0,05 н. раствора серной кислоты. Хлориды. 4 мл того же фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,01% в препарате). Сульфаты. 5 мл того же фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на сульфаты (не более 0,04% в препарате). Метиловый спирт. 1 г препарата взбалтывают с 10 мл воды в течение 5 минут и фильтруют. К 5 мл полученного фильтрата прибавляют 2 мл раствор перманганата калия в фосфорной кислоте, перемешивают и оставляют на 10 минут. Затем добавляют по каплям насыщенный раствор бисульфита натрия до обесцвечивания раствора, 1 мл свежеприготовленного 2% раствора динатриевой соли хромотроповой кислоты, 10 мл концентрированной серной кислоты и перемешивают.не должно быть фиолетового окрашивания. Потеря в весе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100—105° до постоянного веса. Потеря в весе не должна превышать 1%. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,2 г препарата (точная навеска) помещают в колбу Кьельдаля емкостью 250 мл, прибавляют 1 г растертой смеси сульфата калия и сульфата меди (1 : 10), 0,05 г селена и 7 мл концентрированной серной кислоты. 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02103 г (Ci9H2oN2)2-CioH806S2, которого в пересчете на сухое вещество должно быть не менее 99,0%. Хранение. Список Б. В таре, предохраняющей от действия влаги и света. Высшая разовая доза внутрь 0,3 г. Высшая суточная доза внутрь 0,6 г. Противогистаминное (противоаллергическое) средство |
||||
| дата | Характер и содержание выполненной работы | Подпись | ||
| 01.04. | Анализ экстемпоральных лекарственных форм (порошки, микстуры, мази, глазные капли, растворы для инъекций и др.) Пропись 1 Дифенгидрамина гидрохлорида (димедрола) 0.5 Кислоты аскорбиновой 5,0 Воды до 100 мл. Описание. Бесцветная прозрачная жидкость. Подлинность. 1. Выпаривают 2-3 капли раствора на водяной бане. После охлаждения к сухому остатку прибавляют 4-5 капель концентрированной серной кислоты, появляется желтое окрашивание, исчезающее при добавлении 2-3 капель воды (дифенгидрамина гидрохлорид). 2. К 1-2 каплям раствора прибавляют по 1-2 капли растворов гексациано-(III)феррата калия и железа (III) хлорида, появляется синее окрашивание (кислота аскорбиновая). Количественное определение. Дифенгидрамина гидрохлорид (димедрол). К 2 мл раствора прибавляют 5-6 мл раствора железоаммониевых квасцов, 2 мл разведенной азотной кислоты, 3 мл раствора серебра нитрата (0,02 моль/л) и титруют раствором аммония тиоцианата (0,02 моль/л) до желто-розового окрашивания. М.м. 291,82. Кислота аскорбиновая К 1 мл раствора прибавляют 2 мл 95% спирта и титруют раствором йода (0,1 моль/л, УЧ ½ I2) до слабо-желтого окрашивания. М.м. 176.13. Пропись 2. Кальция хлорида 3,0 Калия йодида 2,0 Воды очищенной 100,0 мл. Вариант I. Кальция хлорид определяют трилонометрически, а калия йодид — по методу Фаянса с индикатором натрия эозинатом (хлорид-ионы не метают титрованию с индикатором натрия эозинатом). Методика. Кальция хлорид, К 2 мл микстуры прибавляют 4-5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси или 5—7 капель раствора кислотного хром-темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания. ! мл 0,05 М раствора трилона Б соответствует 0,01095 г СаС12-6Н20: 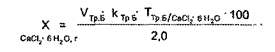 Калия йодид. К 2 мл микстуры прибавляют ! мл разведенной кислоты уксусной, 3—5 капель раствора натрия эозината и титруют 0,! н. раствором серебра нитрата до ярко-розового окрашивания осадка. i мл 0,5 н. раствора серебра нитрата соответствует 0,01660 г Ki: Калия йодид. К 2 мл микстуры прибавляют ! мл разведенной кислоты уксусной, 3—5 капель раствора натрия эозината и титруют 0,! н. раствором серебра нитрата до ярко-розового окрашивания осадка. i мл 0,5 н. раствора серебра нитрата соответствует 0,01660 г Ki: 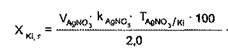 Аргентометрическое титрование йодидов можно проводить с применением внешнего индикатора - нитрозо-крахмальной бумаги. Вариант II. Кальция хлорид определяют трилонометрически, а калия йодид — методом аргетометрии с применением внешнего индикатора. Определение конечной точки титрования основано на реакции йодидов с нитритом натрия в кислой среде: 2 NaN02 + 2 Nal + 2 H2S04 = I, + 2 NO + 2 Na,S04 + 2 H20. Титрование стандартным 0,1 н. раствором серебра нитрата проводят до тех пор, пока капля реакционной среды, нанесенная на нит-розо-крахмальную бумагу, не будет вызывать ее посинения вследствие выделения йода. Для получения более точных результатов необходимо предварительно рассчитать объем 0,! н. титрованного раствора серебра нитрата, который должен пойти на титрование взятой навески. Можно также провести вначале ориентировочное титрование. В данном случае V 0,1 н. раствора серебра нитрата, необходимый для титрования ! мл микстуры с содержанием 0,02 г калия йодида, рассчитывают по формуле: Аргентометрическое титрование йодидов можно проводить с применением внешнего индикатора - нитрозо-крахмальной бумаги. Вариант II. Кальция хлорид определяют трилонометрически, а калия йодид — методом аргетометрии с применением внешнего индикатора. Определение конечной точки титрования основано на реакции йодидов с нитритом натрия в кислой среде: 2 NaN02 + 2 Nal + 2 H2S04 = I, + 2 NO + 2 Na,S04 + 2 H20. Титрование стандартным 0,1 н. раствором серебра нитрата проводят до тех пор, пока капля реакционной среды, нанесенная на нит-розо-крахмальную бумагу, не будет вызывать ее посинения вследствие выделения йода. Для получения более точных результатов необходимо предварительно рассчитать объем 0,! н. титрованного раствора серебра нитрата, который должен пойти на титрование взятой навески. Можно также провести вначале ориентировочное титрование. В данном случае V 0,1 н. раствора серебра нитрата, необходимый для титрования ! мл микстуры с содержанием 0,02 г калия йодида, рассчитывают по формуле:  Следует отметить, что определению йодидов по реакции с натрия нитритом не мешают хлориды и бромиды. Кроме приведенных вариантов аргентометрического титрования, возможно определять сумму калия йодида и кальция хлорида но методу Фольгарда или Фаянса (с индикатором бромфеноловым синим), а затем содержание калия йодида рассчитывать но разности между объемом титрованного раствора, израсходованным на титрование суммы галогенидов, и объемом трилона Б, пошедшим на титрование кальция хлорида: Следует отметить, что определению йодидов по реакции с натрия нитритом не мешают хлориды и бромиды. Кроме приведенных вариантов аргентометрического титрования, возможно определять сумму калия йодида и кальция хлорида но методу Фольгарда или Фаянса (с индикатором бромфеноловым синим), а затем содержание калия йодида рассчитывать но разности между объемом титрованного раствора, израсходованным на титрование суммы галогенидов, и объемом трилона Б, пошедшим на титрование кальция хлорида:  Пропись 3. Кислоты глутамшювой 0,3 Кислоты аскорбиновой 0,1. Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида, а затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую. Расчет содержания кислоты глутаминовой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 н. раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 н. раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой, Пропись 3. Кислоты глутамшювой 0,3 Кислоты аскорбиновой 0,1. Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида, а затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую. Расчет содержания кислоты глутаминовой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 н. раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 н. раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой, 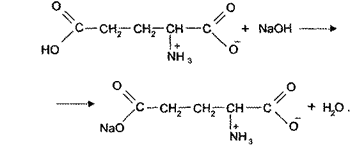 Реакции кислоты аскорбиновой с натрия гидроксидом и йодом — см. пропись 15. Методика. Кислота глутамииовая и кислота аскорбиновая. 0,1 г порошка растворяют в 5 мл воды, добавляют 2 капли раствора нейтрального красного и титруют 0,1 н, раствором натрия гидроксида до желтого окрашивания. Кислота аскорбиновая. К оттитрованной жидкости прибавляют крахмал и Реакции кислоты аскорбиновой с натрия гидроксидом и йодом — см. пропись 15. Методика. Кислота глутамииовая и кислота аскорбиновая. 0,1 г порошка растворяют в 5 мл воды, добавляют 2 капли раствора нейтрального красного и титруют 0,1 н, раствором натрия гидроксида до желтого окрашивания. Кислота аскорбиновая. К оттитрованной жидкости прибавляют крахмал и 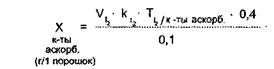 титруют 0,1 н. раствором йода до синего окрашивания. 1 мл 0,1 н. раствора йода соответствует 0,008806 т кислоты аскорбиновой. титруют 0,1 н. раствором йода до синего окрашивания. 1 мл 0,1 н. раствора йода соответствует 0,008806 т кислоты аскорбиновой. 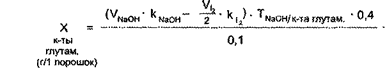 1 мл 0,1 н. раствора натрия гидроксида соответствует 0,01471 г C5H9N04 (кислоты глутаминовой). 1 мл 0,1 н. раствора натрия гидроксида соответствует 0,01471 г C5H9N04 (кислоты глутаминовой). |
|||
| дата | Характер и содержание выполненной работы | Подпись | ||
| 04.04 | Анализ экстемпоральных лекарственных форм Пропись 1 .Бензил пенициллина калиевой соли 100 000 ЕД Раствора натрия хлорида 0,9% 10 мл Определение подлинности. Бензилпенициллина калиевая соль. I. К 5—6 каплям раствора прибавляют 1 каплю реактива, состоящего из 1 мл I моль/л раствора гидроксиламина гидрохлорида и 0,3 мл I моль/л раствора натрия гидрок-сида. Через 2—3 мин добавляют I каплю I моль/л раствора уксусной кислоты и после перемешивания — 1 каплю раствора меди нитрата. Через I мин образуется зеленый осадок. 2. Помещают 0,5 мл раствора в фарфоровую чашку, прибавляют 3—4 капли раствора натрия гидроксида, выпаривают на сетке и сухой остаток осторожно нагревают до появления красноватого окрашивания. После охлаждения добавляют 1—2 капли 5% раствора натрия нитропрус-сида. Появляется быстро исчезающее красно-фиолетовое окрашивание. Количественное определение. Бензилпенициллина калиевая соль. Помещают I мл раствора в мерную колбу вместимостью 25 мл и объем доводят фосфатным буферным раствором 1 (рН 6,0) до метки (раствор А). Переносят 5 мл раствора А в колбу с притертой пробкой, прибавляют 2 мл 1 моль/л раствора натрия гидроксида и оставляют на 15 мин. Затем добавляют 2,4 мл 1 моль/л раствора соляной кислоты и 10 мл 0,01 моль/л раствора йода. Колбу закрывают и оставляют на 20 мин в темном месте. Избыток йода оттитровывают 0,01 моль/л раствором натрия тиосульфата до обесцвечивания (индикатор— крахмал) (А мл). Параллельно проводят контрольный опыт: к 5 мл раствора А прибавляют 0,4 мл 1 моль/л раствора соляной кислоты, 10 мл 0,01 моль/л раствора йода и титруют 0,01 моль/л раствором натрия тиосульфата (Б мл). 1 мл 0,01 моль/л раствора йода соответствует 0,0004139 г стандартного образца бензилпенициллина калиевой соли. Содержание (X) калиевой соли бензилпенициллина в граммах вычисляют по формуле:  где а — объем раствора, взятый для анализа, мл. Натрия хлорид. К 1 мл раствора прибавляют 2 мл воды и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета (индикатор — хромат калия). 1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,005844 г натрия хлорида. Пропись 2. Раствор натрия парааминосалицилата 3% Состав: Натрия парааминосалицилата 3 г Натрия сульфита безводного 0,5 г Воды для инъекций до 100 мл Определение подлинности. Натрия парааминосалицилат. 1. К 3—4 каплям раствора прибавляют 1 2 мл воды и по 2—3 капли разведенной соляной кисло ты и раствора окисного железа хлорида. Появляется фиолетово-красное окрашивание. 2. К 3—4 каплям раствора прибавляют 0,5—1 мл воды, 5—6 капель разведенной соляной кислоты, 3—4 капли 0,1 моль/л раствора натрия нитрита и 0,1—0,3 мл полученной смеси вливают в 1-—2 мл щелочного раствора р-нафтола. Появляется красное окрашивание. 3. К 0,5 мл раствора прибавляют 4—5 капель раствора меди ацетата. Образуется зеленый осадок, быстро переходящий в темно-коричневый. Натрия сульфит. 1. К 4—5 каплям раствора прибавляют 2—3 капли раствора бария хлорида. Образуется белый осадок, растворимый в разведенной соляной кислоте. 2. К 0,5—1 мл раствора прибавляют 5—6 капель разведенной серной кислоты и нагревают до кипения. Выделяется сернистый ангидрид, обнаруживаемый по запаху. Количественное определение. Натрия параамино-салицилат. Помещают 5 мл раствора в мерную колбу вместимостью 50 мл, прибавляют 1,5 мл раствора бария хлорида и объем доводят водой до метки. Раствор фильтруют через сухой двойной, складчатый фильтр в сухую колбу. Первые 8—10 мл фильтрата отбрасывают. К 10 мл фильтрата прибавляют 2 мл разведенной солями кислоты, 0,2 г калия бромида, 2 капли раствора тропиолина коплю раствора метиленового синего и при 18-20ºтитрую 0,1 моль/л раствором натрия нитрита, оставляя его в начале по 0,2—0,3 мл через 1 мин, а в Не титрования (за 0,1—0,2 мл до точки эквивалентно- сти) по 1—2 капли через 1 мин до перехода красно-фиолетовой окраски в зеленую. 1 мл 0,1 моль/л раствора натрия нитрита соответствует 0,02112 г натрия парааминосалицилата. Натрия сульфит. К 2 мл воды прибавляют 1 Мд разведенной серной кислоты, 2 мл анализируемого раствора и быстро титруют 0,1 моль/л раствором йода (индикатор — крахмал). 1 мл 0,1 моль/л раствора йода соответствует 0,006303 г натрия сульфита безводного, содержание которого в растворе не должно превышать 0,5 г. Пропись 3. .Раствор «Дисоль». Состав. Натрия ацетата 2,0 Натрия хлорида 6,0 Воды для инъекций до 1 л Описание. Прозрачная бесцветная жидкость. Подлинность. Хлориды. К 0,5 мл раствора прибавляют 0,5 мл разведенной азотной кислоты и 2-3 капли раствора нитрата серебра. Образуется белый творожистый осадок, растворимый в растворе аммиака. Натрий-ион. Микрокристаллоскопическая реакция с пикриновой кислотой. Ацетат-ион. К 1-1,5 мл раствора прибавляют 2-3 капли раствора железа(III)хлорида. Появляется красно-бурое окрашивание. рН 6,5-7,5 (потенциометрически или по универсальной индикаторной бумаге). Количественное определение. Натрия хлорид. 1 мл раствора титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка (индикатор – калия хромат). 1 мл раствора серебра нитрата соответствует 0,005844 г натрия хлорида, которого в 1 мл раствора должно быть 0,0057-0,0063 г. Натрия ацетат. 5 мл раствора титруют раствором хлороводородной кислоты (0,05 моль/л) до желтого окрашивания (индикатор – бромтимоловый синий). 1 мл раствора хлороводородной кислоты (0,05 моль/л) соответствует 0,006804 г натрия ацетата (водного), которого в 1 мл раствора должно быть 0,0019-0,0021 г. где а — объем раствора, взятый для анализа, мл. Натрия хлорид. К 1 мл раствора прибавляют 2 мл воды и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета (индикатор — хромат калия). 1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,005844 г натрия хлорида. Пропись 2. Раствор натрия парааминосалицилата 3% Состав: Натрия парааминосалицилата 3 г Натрия сульфита безводного 0,5 г Воды для инъекций до 100 мл Определение подлинности. Натрия парааминосалицилат. 1. К 3—4 каплям раствора прибавляют 1 2 мл воды и по 2—3 капли разведенной соляной кисло ты и раствора окисного железа хлорида. Появляется фиолетово-красное окрашивание. 2. К 3—4 каплям раствора прибавляют 0,5—1 мл воды, 5—6 капель разведенной соляной кислоты, 3—4 капли 0,1 моль/л раствора натрия нитрита и 0,1—0,3 мл полученной смеси вливают в 1-—2 мл щелочного раствора р-нафтола. Появляется красное окрашивание. 3. К 0,5 мл раствора прибавляют 4—5 капель раствора меди ацетата. Образуется зеленый осадок, быстро переходящий в темно-коричневый. Натрия сульфит. 1. К 4—5 каплям раствора прибавляют 2—3 капли раствора бария хлорида. Образуется белый осадок, растворимый в разведенной соляной кислоте. 2. К 0,5—1 мл раствора прибавляют 5—6 капель разведенной серной кислоты и нагревают до кипения. Выделяется сернистый ангидрид, обнаруживаемый по запаху. Количественное определение. Натрия параамино-салицилат. Помещают 5 мл раствора в мерную колбу вместимостью 50 мл, прибавляют 1,5 мл раствора бария хлорида и объем доводят водой до метки. Раствор фильтруют через сухой двойной, складчатый фильтр в сухую колбу. Первые 8—10 мл фильтрата отбрасывают. К 10 мл фильтрата прибавляют 2 мл разведенной солями кислоты, 0,2 г калия бромида, 2 капли раствора тропиолина коплю раствора метиленового синего и при 18-20ºтитрую 0,1 моль/л раствором натрия нитрита, оставляя его в начале по 0,2—0,3 мл через 1 мин, а в Не титрования (за 0,1—0,2 мл до точки эквивалентно- сти) по 1—2 капли через 1 мин до перехода красно-фиолетовой окраски в зеленую. 1 мл 0,1 моль/л раствора натрия нитрита соответствует 0,02112 г натрия парааминосалицилата. Натрия сульфит. К 2 мл воды прибавляют 1 Мд разведенной серной кислоты, 2 мл анализируемого раствора и быстро титруют 0,1 моль/л раствором йода (индикатор — крахмал). 1 мл 0,1 моль/л раствора йода соответствует 0,006303 г натрия сульфита безводного, содержание которого в растворе не должно превышать 0,5 г. Пропись 3. .Раствор «Дисоль». Состав. Натрия ацетата 2,0 Натрия хлорида 6,0 Воды для инъекций до 1 л Описание. Прозрачная бесцветная жидкость. Подлинность. Хлориды. К 0,5 мл раствора прибавляют 0,5 мл разведенной азотной кислоты и 2-3 капли раствора нитрата серебра. Образуется белый творожистый осадок, растворимый в растворе аммиака. Натрий-ион. Микрокристаллоскопическая реакция с пикриновой кислотой. Ацетат-ион. К 1-1,5 мл раствора прибавляют 2-3 капли раствора железа(III)хлорида. Появляется красно-бурое окрашивание. рН 6,5-7,5 (потенциометрически или по универсальной индикаторной бумаге). Количественное определение. Натрия хлорид. 1 мл раствора титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка (индикатор – калия хромат). 1 мл раствора серебра нитрата соответствует 0,005844 г натрия хлорида, которого в 1 мл раствора должно быть 0,0057-0,0063 г. Натрия ацетат. 5 мл раствора титруют раствором хлороводородной кислоты (0,05 моль/л) до желтого окрашивания (индикатор – бромтимоловый синий). 1 мл раствора хлороводородной кислоты (0,05 моль/л) соответствует 0,006804 г натрия ацетата (водного), которого в 1 мл раствора должно быть 0,0019-0,0021 г. |
|||
| дата | Характер и содержание выполненной работы | Подпись | ||
| 05.04, | Анализ экстемпоральных лекарственных форм (порошки, микстуры, мази, глазные капли, растворы для инъекций и др.) Пропись 1. Натрия хлорида 0,2 Натрия гидрокарбоната Натрия тетрабората по 0,4 Воды очищенной до 40,0 мл. Смесь титруют стандартным раствором кислоты хлороводородной, объем которой соответствует сумме натрия гидрокарбоната и натрия тетрабората: NaHCO,+ ИС1= NaCl + C02t + Н20; Na2B407+ 2 НС1+ 5 Н,0= 4 H3B03+ 2 NaCl. Выделившуюся борную кислоту в присутствии глицерина титруют стандартным раствором натрия гидроксида:  Количество 0,1 н. раствора натрия гидроксида используют для расчета натрия тетрабората. А натрия гидрокарбонат определяют по разности между объемами стандартных растворов кислоты хлороводородной и натрия гидроксида. Методика, Натрия хлорид. К 1 мл раствора прибавляют 3-4 капли раствора бромфенолового синего и по каплям кислоту уксусную разведенную —до прекращения выделения пузырьков углерода (IV' оксида и появления зеленовато-желтого окрашивания и титруют 0,1 н. раствором серебра нитрата до окрашивания осадка в фиолетовый цвет'. 1 мл 0,1 н. раствора серебра нитрата соответствует 0,005844 i NaCl. Количество 0,1 н. раствора натрия гидроксида используют для расчета натрия тетрабората. А натрия гидрокарбонат определяют по разности между объемами стандартных растворов кислоты хлороводородной и натрия гидроксида. Методика, Натрия хлорид. К 1 мл раствора прибавляют 3-4 капли раствора бромфенолового синего и по каплям кислоту уксусную разведенную —до прекращения выделения пузырьков углерода (IV' оксида и появления зеленовато-желтого окрашивания и титруют 0,1 н. раствором серебра нитрата до окрашивания осадка в фиолетовый цвет'. 1 мл 0,1 н. раствора серебра нитрата соответствует 0,005844 i NaCl.
Натрия тетраборат и натрия гидрокарбонат. К 1 мл раствор; прибавляют 3 мл свежепрокипяченной охлажденной воды, 2—3 каши метилового оранжевого и титруют 0,1 и. раствором кислоты хлороводородной до появления розового окрашивания. Оттитрованный раствор нагревают до кипения (для удаленю углекислоты), охлаждают, прибавляют 2 мл нейтрализованного ж фенолфталеину глицерина и титруют 0,1 н. раствором натрия гид роксида. 1 мл 0.1 н. раствора натрия гидроксида соответствует 0,009534 Na,B407- Содержание натрия гидр studopedia.ru |
Читайте также
![Принципы количественного определения ферментов Принципы количественного определения ферментов]() Принципы количественного определения ферментов
Принципы количественного определения ферментов![Количественное определение аскорбиновой кислоты Количественное определение аскорбиновой кислоты]() Количественное определение аскорбиновой кислоты
Количественное определение аскорбиновой кислоты![Электрический ток определение Электрический ток определение]() Электрический ток определение
Электрический ток определение![3 Закон ньютона определение 3 Закон ньютона определение]() 3 Закон ньютона определение
3 Закон ньютона определение![Акт определение Акт определение]() Акт определение
Акт определение![Административное право определение Административное право определение]() Административное право определение
Административное право определение![Автомобиль определение Автомобиль определение]() Автомобиль определение
Автомобиль определение![Вес определение Вес определение]() Вес определение
Вес определение![Анкета определение Анкета определение]() Анкета определение
Анкета определение![База данных определение База данных определение]() База данных определение
База данных определение![Безработица определение Безработица определение]() Безработица определение
Безработица определение![Бетон определение Бетон определение]() Бетон определение
Бетон определение
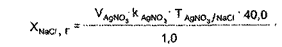
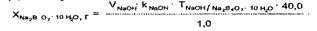 lf) Н,0.
lf) Н,0. Принципы количественного определения ферментов
Принципы количественного определения ферментов Количественное определение аскорбиновой кислоты
Количественное определение аскорбиновой кислоты Электрический ток определение
Электрический ток определение 3 Закон ньютона определение
3 Закон ньютона определение Акт определение
Акт определение Административное право определение
Административное право определение Автомобиль определение
Автомобиль определение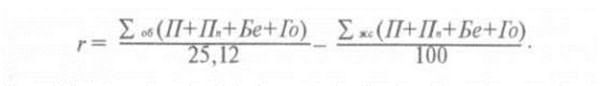 Вес определение
Вес определение Анкета определение
Анкета определение База данных определение
База данных определение Безработица определение
Безработица определение Бетон определение
Бетон определение