ПРИНЦИПЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ

|
www.biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
53 |
ге, креатинкиназа-2– по одной М и В субъединице активна в миокарде,креатинкиназа-3– двеМ-субъединицы,специфична для скелетной мышцы.
Также существует пять изоферментов лактатдегидрогеназы (ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединицН (англ. heart – сердце) иМ (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват.ЛДГ-4(H1M3) иЛДГ-5(М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладаетЛДГ-3(H2M2).
МУЛЬТИФЕРМЕНТНЫЕ КОМПЛЕКСЫ
Вмультиферментном комплексе несколько ферментов
(например, Е1, Е2, Е3) прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
Например, пируватдегидрогеназный комплекс, пре-
вращающий пируват в ацетил-SКоА,α-кетоглутаратдегид- рогеназный комплекс, превращающийα-кетоглутаратв сук-
цинил-SКоА,комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
1.Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
|
Активность фермента = |
Количество продукта или субстрата |
|
Количество времени × Масса или объем пробы |
|
Ферменты, свойства, классификация, регуляция активности |
54 |
В практике обычно используют:
o единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
o единицы времени – минута, час, секунда,
o единицы массы или объема – грамм (кг, мг), литр (мл).
Активно используются и другие производные – катал (моль/с),международная единица активности (МЕ, Unit) соответствует мкмоль/мин.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д. Например, известно, что 1 г пепсина расщепляет 50 кг яичного белка за один час – таким образом, его активность составит 50 кг/час на 1 г фермента. Если количество слюны в 1,6 г расщепляет 175 кг крахмала в час – активность амилазы слюны составит 109,4 кг крахмала в час на 1 г слюны.
2.Создание стандартных условий, чтобы можно было сравнивать результаты, полученные
вразных лабораториях – оптимальная рН, и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3.Избыток субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
СВОЙСТВА ФЕРМЕНТОВ
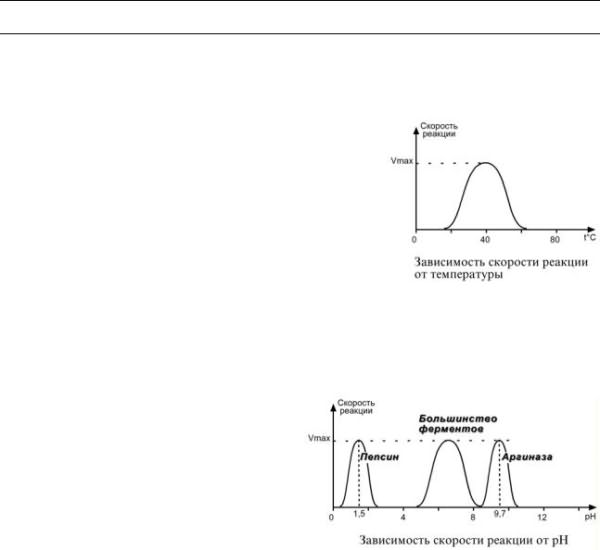
1.Зависимость скорости реакции от температуры – описывается колоколообразной кри-
вой с максимумом скорости при значениях оптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до55-60°С,т.е. в значениях до денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров.
При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3- 5°С. Это свойство ферментов также используется в хи-
рургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С.
2. Зависимость скорости реакции от рН – описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5,трипсина8,0-8,5,амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы4,5-5,0,сукцинатдегидрогеназы 9,0.
3.Зависимостьскорости реакции от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает
StudFiles.ru
2.8. Регуляция активности ферментов в процессе метаболизма
Адаптация организма к меняющимся условиям (режим питания, экологические воздействия и пр.) возможна благодаря изменению активности ферментов. Существует несколько возможностей регуляции скорости ферментных реакций в организме:
-
Изменение скорости синтеза ферментов (этот механизм требует длительного отрезка времени).
-
Увеличение доступности субстрата и фермента путём изменения проницаемости клеточных мембран.
-
Изменение активности ферментов, уже имеющихся в клетках и тканях. Данный механизм осуществляется с большой скоростью и носит обратимый характер.
В многоступенчатых ферментативных процессах выделяютрегуляторные, ключевыеферменты, которые ограничивают суммарную скорость процесса. Чаще всего ими являются ферменты начальной и конечной стадий процесса(F1 иF3на схеме). Изменение активности ключевых ферментов происходит по различным механизмам.
многоступенчатых ферментативных процессах выделяютрегуляторные, ключевыеферменты, которые ограничивают суммарную скорость процесса. Чаще всего ими являются ферменты начальной и конечной стадий процесса(F1 иF3на схеме). Изменение активности ключевых ферментов происходит по различным механизмам.
-
Аллостерический механизм:
![]()
-
Изменение олигомерности фермента:
Мономеры не активные ↔ олигомеры активные
-
Фосфолирирование - дефосфорилирование:
Фермент (неактивный) + Н3РО4↔ фосфорилированный активный фермент.
В клетках широко распространено ретроингибирование, при котором продукты ферментативного процесса угнетают ферменты начальных стадий (на схеме конечный продукт Dугнетает активностьF1). Например, высокие концентрации пуриновых и пиримидиновых нуклеотидов угнетают начальные в стадии их синтеза.
Иногда исходные субстраты активируют конечные ферменты, на схеме: субстрат А активирует F3. Например, активная форма глюкозы (глюкозо-6-фосфат) активирует конечный фермент синтеза гликогена из глюкозы (гликогенсинтетазу).
2.9. Структурная организация ферментов в клетке
Слаженность обменных процессов в организме возможна благодаря структурной разобщенности ферментов в клетках. Отдельные ферменты располагаются в тех или иных внутриклеточных структурах – принцип компартментализации.Например, в плазматической мембране активен фермент калий - натриевая АТФ-аза. В митохондриях активны ферменты окислительных реакций (сукцинатдегидрогеназа, цитохромоксидаза). В ядре высока активность ферментов синтеза нуклеиновых кислот (ДНК-полимераза). В лизосомах активны ферменты расщепления различных веществ (РНК - аза, фосфатаза и другие).
Ферменты, наиболее активные в данной клеточной структуре, называются индикаторнымиилимаркернымиферментами. Изменение их активности отражает глубину структурных повреждений ткани. Некоторые ферменты объединяются в полиферментные комплексы, например, пируватдегидрогеназный комплекс (ПДК), осуществляющий окисление пировиноградной кислоты.
2.10. Принципы обнаружения и количественного определения ферментов:
Обнаружение ферментов основано на их высокой специфичности. Ферменты обнаруживают по производимому ими действию, т.е. по факту протекания той реакции, которую катализирует данный фермент. Например, амилазу обнаруживают по реакции расщепления крахмала до глюкозы.
Критериями протекания ферментативной реакции могут быть:
-
исчезновение субстрата реакции;
-
появление продуктов реакции;
-
изменение оптических свойств кофермента.
StudFiles.ru
Основы количественного определения активности ферментов
 1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
Активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
2. Создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях – оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3. Необходимо наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
За единицу активности любого фермента принимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту. Активность ферментов опр-ют: пог скорости убыв субстрата; по скороти обр-я продукта. Удельная активность=мкм/мин.мг белка.
5. Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств.
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются АК, значительно удаленные друг от друга в линейной цепи, но сближенные в функциональной конформации. Наиболее часто в состав активного центра входят такие АК как серин, гистидин, трионин, цистеин.
Активный центр: -каталитический центр, -субстрат-связывающий участок, -кофермент-связывающий участок, - низкомолекулярное соединение, которое способствует взаимодействию субстрата и фермента.
Микросреда активного центра отличается от остального окружения фермента более низкой диэлектрической проницаемостью, приближающейся к таковой для некоторых органических растворителей. Также хар-ся повышенной микровязкостью, что ограничивает свободу вращательного движения группировок активного центра. Активный центр ограничивает влияние воды, что необходимо для эффективного катализа. При связывании субстрата и активного центра, субстрат претерпевает конформационные изменения (комплементарность увеличивается). – это явление индуцированного соответствия. В свою очередь в активном центре выделяют два участка:
1) якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2) каталитический – непосредственно отвечает за осуществление реакции.
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Энергия активации – это произведение энергии активации элементарного акта и постоянной Авогадро (Дж,/моль).
-Это энергетический барьер, который должны преодолеть молекулярные вещества по пути превращения в продукты реакции. Основная задача фермента – снизить Е активации.
Если фермент просто связывается с субстратом – этого не достаточно для катализа. Ф. не только распознает и связывает субстрат, но и индуцирует переходное состояние субстрата.
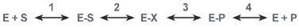 В ферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
В ферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Механизмы катализа: 1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций (Доноры -СООН -NH3+ -SH, Акцепторы -СОО- -NH2 -S-)
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Типы ферментативных реакций: 1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование. 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Ингибитор - вещество, вызывающее специфичное снижение активности фермента. Т.о., неорганические к-ты и тяжелые Ме ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично.
Можно выделить два основных направления ингибирования:
1. по прочности связывания Ф. с ингибитором ингибирование бывает обратимым и необратимым.
2. по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
При необратимом ингибировании происходит связывание или разрушение функциональных групп Ф., необходимых для проявления его каталитической активности (модификации подвергается активный центр). Бывают: а)Специфические (блокируют определенные группы активного центра: диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию); б) Неспецифические (реагирует с любыми свободными SН-группами белков. Не имеют физиологического значения и являются ферментными ядами: Присоединение ацетильной группы аспирина (ацетилсалициловой к-ты) к аминогруппе в активном центре фермента циклооксигеназы вызывает инактивацию последнего и прекращение синтеза простагландинов).
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента слабыми нековалентными связями, вследствие чего активность фермента постепенно восстанавливается. Действует не долго. Пр.: прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентный ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. Пр.: Конкурентное взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. Лекарства: ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Увеличивают активность ацетилхолинэстеразы, конц-я ацетилхолина повышается, усиливается проведение нервного импульса (прозерин, эндрофомит). Антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.
Неконкурентное ингибирование связано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов.
Обратимо, но не может быть ослаблено или устранено повышением конц-ии субстрата. Пр.: синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
studopedia.ru
Методы определения активности ферментов
Из-за низкой активности ферментов в биологических жидкостях, а также из-за трудности дифференциации различных ферментов химическим способом на практике не применяется химическое определение активности ферментов, а измеряется каталитический эффект ферментов путем измерения скорости реакции, при которой субстрат под действием фермента превращается в продукт реакции. Эта величина известна как «скорость реакции» и при определенных условиях прямо пропорциональна количеству присутствующего фермента.
По способу измерения различают: кинетическое измерение, двухточечное измерение, измерение по конечной точке. Преимущество кинетического измерения состоит в возможности прямого непрерывного измерения скорости ферментативной реакции в начальной линейной части кривой при оптимизированной концентрации реактивов. С этой точки зрения наиболее точными являются методы, основанные на оптическом тесте Варбурга. Принцип Варбурга основан на разнице спектрофотометрического поглощения при определенной длине волны (340 нм) восстановленной (NаDН) и окисленной (NаD) форм никотинамидеиннуклеотида. При длине волны 340 нм NаDН имеет максимальную абсорбцию, тогда как NаD не имеет поглощения при данной длине волны. Прямой оптический тест применяется для определения активности дегидрогеназ.
Фотометрические методы основаны на образовании окрашенных соединений с продуктами ферментативной реакции. Измерение проводят по конечной точке, что является недостатком методов этой группы, и точность их ниже, чем методов, основанных на оптическом тесте Варбурга. Исключение составляют методы, в которых в ходе реакции непосредственно из субстрата образуется окрашенное соединение.
Основным принципом ферментной диагностики является выбор оптимального спектра ферментов, изменение активности которых характерно для патологии определенных органов и тканей. Спектр ферментов для диагностики заболеваний некоторых органов:
· сердце – КК, ЛДГ, АСТ;
· скелетные мышцы – КК, АЛД;
· кости – ЩФ;
· кровь – ЛДГ 2, ЛДГ 3;
· поджелудочная железа – α-амилаза, липаза;
· предстательная железа – КФ;
· печень, желчные пути – АЛТ, ХЭ, ЩФ.
Метод определения аспартатаминотрансферазы (АСТ) с
studopedia.ru
Читайте также
- Определение принципов трудового права
![Количественное определение аскорбиновой кислоты Количественное определение аскорбиновой кислоты]() Количественное определение аскорбиновой кислоты
Количественное определение аскорбиновой кислоты![Автомобиль определение Автомобиль определение]() Автомобиль определение
Автомобиль определение![Акт определение Акт определение]() Акт определение
Акт определение![Административное право определение Административное право определение]() Административное право определение
Административное право определение![Вес определение Вес определение]() Вес определение
Вес определение![Архитектура определение Архитектура определение]() Архитектура определение
Архитектура определение![База данных определение База данных определение]() База данных определение
База данных определение![Бетон определение Бетон определение]() Бетон определение
Бетон определение![Брак это определение в производстве Брак это определение в производстве]() Брак это определение в производстве
Брак это определение в производстве![Власть определение Власть определение]() Власть определение
Власть определение![Восприятие определение Восприятие определение]() Восприятие определение
Восприятие определение
 Количественное определение аскорбиновой кислоты
Количественное определение аскорбиновой кислоты Автомобиль определение
Автомобиль определение Акт определение
Акт определение Административное право определение
Административное право определение Вес определение
Вес определение Архитектура определение
Архитектура определение База данных определение
База данных определение Бетон определение
Бетон определение Брак это определение в производстве
Брак это определение в производстве Власть определение
Власть определение Восприятие определение
Восприятие определение