Анализ на чувствительность к антибиотикам: суть, как сдавать, расшифровка
Анализ на чувствительность к антибиотикам является обязательным при возникновении у врача подозрений, что заболевание пациента имеет бактериальную природу. Это связано с тем, что медики пытаются контролировать назначение данных препаратов, чтобы не стимулировать мутации и не вызывать резистентность у микроорганизмов.
Определение
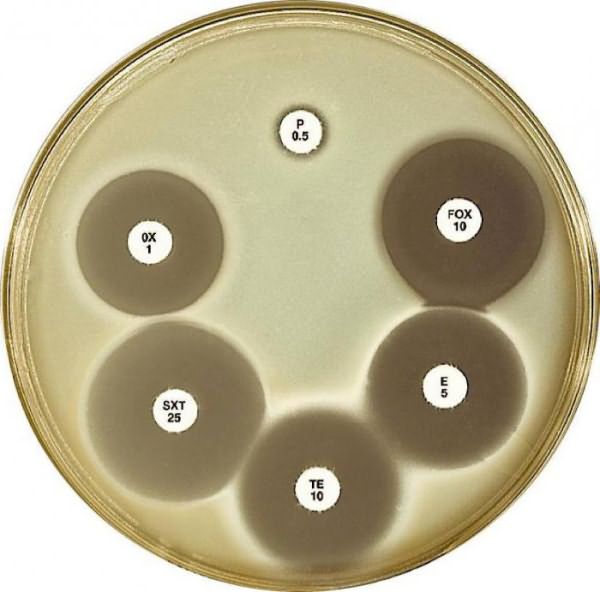
Анализ на чувствительность к антибиотикам – это лабораторный способ выявления препарата, который будет оказывать наибольшее действие на патогенную флору в данном конкретном случае болезни.
На данный момент антибактериальная терапия применяется достаточно широко там, где она нужна, а также в тех случаях, когда это совсем не обязательно, для перестраховки от возможных осложнений. Например, после кесарева сечения, лапароскопических операций, удаления конкрементов из почек или мочеточников и т. д.
Фармацевтическая промышленность может предложить широкий выбор препаратов как в плане цены, так и в плане действенности. Для того чтобы не «тыкать пальцем в небо» и назначить эффективный антибиотик, нужно провести посевы на чувствительность.
Показания
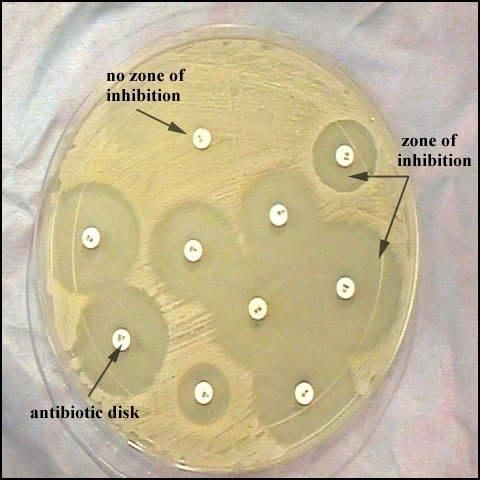
Перед тем как врач подберет терапию, пациенту необходимо сдать некоторые анализы. Посев на чувствительность к антибиотикам назначается, если необходимо определить лекарство, которое в данном случае будет наиболее уместно. Чаще всего это исследование назначается для лечения заболеваний, передающихся половым путем, или ЗППП. Для детей же необходимость в определении антибиотика – это обязательное условие.
Кроме того, определение чувствительности нужно, чтобы избежать устойчивости бактерий к лечению. Если пациента недавно лечили антибиотиками, и теперь вновь необходим повторный курс, то требуется замена препарата. Это позволит использовать меньшие дозы лекарства и не вызывать мутации у возбудителя. В гнойных хирургических отделениях антибиотики меняют каждые два-три месяца.
Данный анализ необходим еще в том случае, если на основную группу антибиотиков у больного возникает аллергическая реакция.
Диффузионные методы

Анализ мочи на чувствительность к антибиотикам, и не только ее, можно провести несколькими способами. Первый из них – это метод дисков. Проводят его следующим образом. В чашку Петри заливают агар, а когда он застынет, специальным инструментом наносят исследуемый материал. Затем по поверхности агара раскладывают бумажные диски, пропитанные антибиотиками. После чашку закрывают и ставят в термостат. Постепенно диск погружается в желатин, а антибиотик диффундирует в окружающее пространство. Вокруг бумаги образуется зона «подавления роста». Чашки проводят в термостате двенадцать часов, затем их вынимают и измеряют диаметр вышеуказанной зоны.
Второй способ – это метод Е-теста. Он похож на предыдущий, но вместо бумажных дисков используют полоску, которая на своем протяжении в разной степени пропитана антибиотиком. После двенадцати часов экспозиции в термостате чашку Петри достают и смотрят, в каком месте зона подавления роста соприкасается с полоской бумаги. Это будет наименьшая концентрация препарата, которая необходима для лечения заболевания.
Достоинством этих тестов является быстрота и простота их проведения.
Методы разведения

Анализ на флору и чувствительность к антибиотикам можно провести и другим способом. Этот метод основан на последовательном уменьшении концентрации антибиотика (от максимальной до минимальной) с целью определить, в какой из пробирок прекратится сдерживание роста бактерий.
Сначала подготавливают растворы препарата. Затем их вносят в жидкую среду с бактериями (бульон или агар). Все пробирки на ночь (то есть 12 часов) помещаются в термостат при температуре 37 градусов, а утром проводят анализ получившихся результатов. Если содержимое пробирки или чашки Петри мутное, это свидетельствует о росте бактерий и, следовательно, неэффективности антибиотика в данной концентрации. Первая пробирка, в которой визуально не будет определяться рост колоний микроорганизмов, будет считаться достаточной концентрацией для лечения.
Это разведение препарата принято называть минимальной подавляющей концентрацией (МПК). Она измеряется в миллиграммах на литр или микрограммах на миллилитр.
Интерпретация результатов
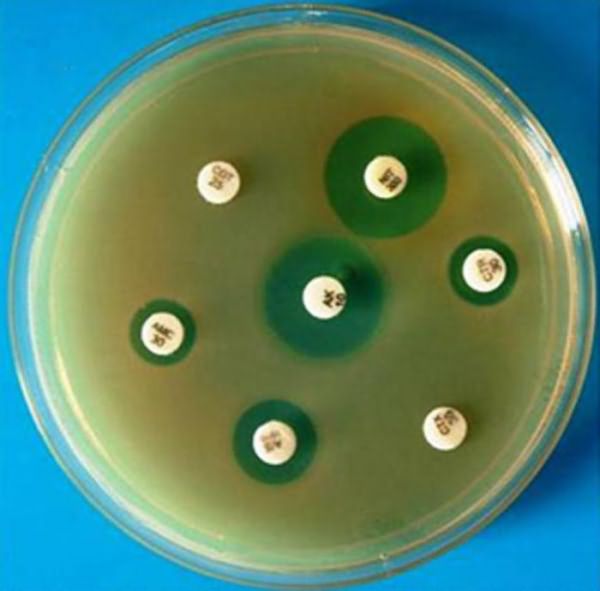
Анализ на чувствительность к антибиотикам нужно уметь не только правильно сделать, но и грамотно расшифровать. Основываясь на получаемых результатах, все микроорганизмы делят на чувствительные, умеренно резистентные и резистентные. Для того чтобы различать их между собой, используются условные пограничные концентрации препаратов.
Эти значения не являются постоянными и могут изменяться в зависимости от приспосабливаемости микроорганизмов. Разработкой и пересмотром этих критериев поручено заниматься химиотерапевтам и микробиологам. Одной из официальных структур такого рода является Национальный комитет по клиническим лабораторным стандартам США. Разработанные ими стандарты признаны во всем мире для использования в оценке активности антибиотиков, в том числе для рандоминизированных многоцентровых исследований.
Различают два подхода к оценке результатов анализа на чувствительность к антибиотикам: клинический и микробиологический. Микробиологическая оценка ориентируется на распределение эффективных концентраций антибиотика, а клиническая - на качество антибактериальной терапии.
Резистентные и чувствительные микроорганизмы
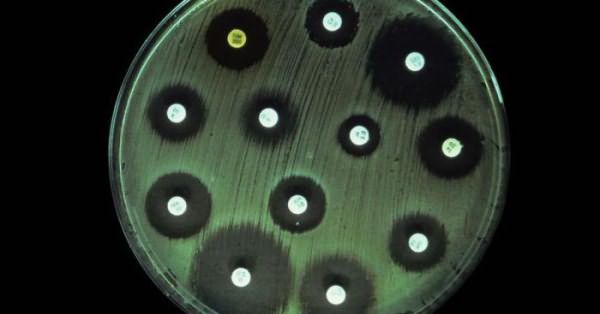
Анализ - определение чувствительности антибиотикам - назначается с целью выявить чувствительные и устойчивые микроорганизмы.
Чувствительными называются возбудители, которые поддаются лечению антибиотиками в средней терапевтической концентрации. Если достоверная информация о категории чувствительности микроорганизма отсутствует, то учитываются данные, полученные в условиях лаборатории. Они совмещаются со знаниями о фармакокинетике используемого препарата, и после синтеза данной информации делается вывод о восприимчивости бактерий к лекарству.
К резистентным, то есть устойчивым, микроорганизмам относятся те бактерии, которые продолжают вызывать заболевания даже при использовании максимальных концентраций лекарственных веществ.
Промежуточную резистентность устанавливают в том случае, если заболевание в процессе лечения может иметь несколько исходов. Выздоровление пациента возможно в случае использования высоких доз антибиотиков либо в случае прицельного накапливания лекарства в месте инфекции.
Минимальная бактерицидная концентрация
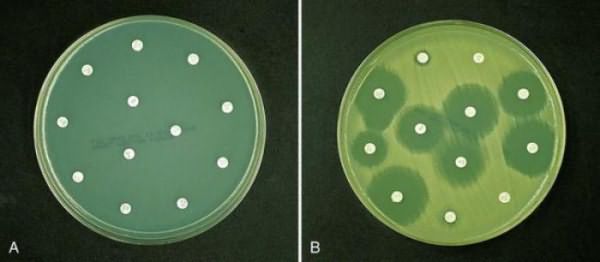
Анализ на микрофлору и чувствительность к антибиотикам определяет такой показатель, как минимальная бактерицидная концентрация, или МБК. Это самая низкая концентрация препарата, которая в лабораторных условиях вызывает элиминацию практически всех микроорганизмов в течение двенадцати часов.
Знание этого показателя врачи используют, когда назначают терапию не бактерицидными, а бактериостатическими лекарственными средствами. Или в случаях, когда стандартная антибактериальная терапия оказывается неэффективной. Чаще всего этот анализ заказывают для больных с бактериальным эндокардитом, остеомиелитом, а также при оппортунистических инфекциях.
Что может быть образцом?
Анализ на чувствительность к антибиотикам может проводиться с использованием биологических жидкостей:
- слюна;
- кровь;
- моча;
- сперма;
- грудное молоко.
Кроме того, для определения местной чувствительности производят забор мазков из уретры, цервикального канала и верхних дыхательных путей.
Подготовка к анализам
Бак. анализ на чувствительность к антибиотикам не требует от пациентов существенной подготовки, но некоторые ограничения все-таки есть.
- Для исследования используется средняя порция утренней мочи, которая собирается в стерильную посуду. Перед этим пациент обязательно должен осуществить туалет наружных половых органов и рук.
- Грудное молоко собирается перед кормлением ребенка. Первая порция сливается, а затем в стерильный контейнер сцеживается несколько миллилитров с каждой груди.
- Перед сдачей мазка из носоглотки стоит воздержаться от приема пищи в течение пяти-шести часов.
- В случае взятия мазка из половых путей, рекомендуют воздерживаться от половых контактов в течение пары дней.
На сегодняшний день не существует клинических или лабораторных методов, которые бы со стопроцентной вероятностью могли предсказать эффект от антибактериальной терапии. Но в то же время определение чувствительности бактерий к лекарственным веществам может быть ориентиром для врачей в вопросах выбора и коррекции лечения.
fb.ru
Методы определения чувствительности к антибиотикам
Из-за формирования антибиотикоустойчивых популяций микроорганизмов с целью эффективного лечения необходимо предварительно определять чувствительность данного антибиотика к выделенной культуре возбудителя.
Основными методами определения антибиотикочувствительности бактерий in vitro является метод серийных разведений, диффузии в агар (бумажных дисков), определение способности к продукции бета- лактамазы, in vivo- на модели безмикробных животных, определение концентрации антибиотиков в крови и моче. Выбор метода зависит от цели исследования и возможностей лаборатории. Диско-диффузный метод следует рассматривать как качественный. Методы разведения – более точные количественные способы исследования. Их применяют в особо важных практических случаях и научно-исследовательской работе.
Метод диффузии в агар с применением стандартных дисков, пропитанных различными антибиотиками в определенных концентрациях (зависят от терапевтической дозы и соотвествуют рекомендациям ВОЗ). Основан на использовании стандартных питательных сред, дисков и методов. Оценка результатов связана с существованием зависимости между размером зоны подавления роста исследуемых культур вокруг дисков и значениями минимальных подавляющих концентраций (МПК)соответствующих антибиотиков (чувствительностью микроорганизмов). Имеются специальные таблицы для оценки результатов, в соответствии с которыми культуры определяют как чувствительные, умеренно устойчивые и устойчивые (резистентные) к тестируемому антибиотику.
Для исследования можно использовать стандартные питательные среды: отечественные среды АГВ №1, №2 и зарубежные – Мюллер-Хинтон агар.
На поверхность подсушенной питательной среды в чашке Петри наносят 1мл исследуемой культуры (18-20 часовой бульонной культуры или стомиллионной суспензии из агаровой культуры., равномерно распределяют путем покачивания чашки и удаляют если необходимо избыток пипеткой. После посева чашки подсушивают при комнатной температуре 10-15 мин. Диски с антибиотиками накладывают пинцетом на равном расстоянии друг от друга и на 2 см от края чашки (на одну чашку не более 6 дисков). Чашки сразу ставят в термостат вверх дном и инкубируют при 370С в течение 18-20 ч (время инкубации зависит от вида исследуемого микроорганизма. Для учета результатов чашки помещают кверху дном на темную матовую поверхность и освещают настольной лампой под углом 450. Допускается учет в проходящем свете. С помощью линейки измеряют диаметры зон задержки роста вокруг дисков, включая диаметр дисков, с точностью до 1мм. Оценку результатов проводят по таблице. В медицинской практике обычно определяют 3 группы микроорганизмов по чувствительности к антибиотикам: чувствительные, среднечувствительные и устойчивые. «Чувствительные» микроорганизмы, когда обычно применяемые дозы антибиотика могут обеспечить лечебный эффект. «Среднечувствительные» микроорганизмы – повышенные дозы антибиотика могут обеспечить лечебный эффеки. «Устойчивые» микроорганизмы – нельзя рассчитывать на лечебный эффект.
Метод серийных разведений антибиотиков позволяет более точно определить МПК, однако из-за громоздкости применяется реже.
Для исследования используют мясопептонный бульон. Основные растворы антибиотиков приготавливают путем взвешивания их порошка и растворения его в стерильной дистиллированной воде, чтобы получить определенную удобную концентрацию. Разведения антибиотиков готовят путем разбавления основного раствора антибиотика бульоном. Для этого используют 11 пробирок. В первую пробирку вносят 2 мл раствора антибиотика и переносят по 1 мл раствора антибиотика из первой пробирки в каждую последующую. Затем суточную бульонную культуру разводят до 105 – 106 микробных тел в 1 мл и вносят по 1 мл во все пробирки с разведениями антибиотика. Посевы инкубируют при 370С. Отмечают первую пробирку с задержкой роста микробов.
Бета- лактамазный тест (определение способности к образованию бета- лактамаз) чаще определяют методом дисков с нитроцефином - цефалоспорином, изменяющим окраску дисков при гидролизе. Положительный тест свидетельствует о резистентности бактерий ко всем бета- лактамаза- чувствительным пенициллинам.
Ускоренные методы определения чувствительности.
Ускоренное определение чувствительности микроорганизмов к антибиотикам осуществляется некоторыми зарубежными автоматизированными системами микробиологических исследований. В кюветах панели содержатся дегидрированные субстраты или диски с антибиотиками. Каждый антибиотик в кювете представлен в одной концентрации, соответствующей критерию принадлежности бактерий к группе «чувствительных» к антибиотику. Одновременно тестируется 20 и более антибиотиков. После внесения взвеси испытуемых бактерий посевы инкубируют при 35-370С в течение 4-5 часов. Результаты регистрируют спектрофотометрически или кондуктометрически сразу при появлении размножения бактерий в контроле без антибиотика.
StudFiles.ru
Методы определения чувствительности бактерий к антибиотикам
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы)обычно применяют:
• Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков). Метод дисков — качественныйи позволяет оценить, чувствителен или устойчив микроб к препарату.
• Методы определенияминимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественныеметоды, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Есть ускоренные способы, с применением автоматических анализаторов.
Определение чувствительности бактерий к антибиотикам методом дисков.Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри.
Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений.Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Определение антибиотика в крови, моче и других жидкостях организма человека.В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом — исследуемой жидкости. Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой. При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина — Е. coli. После инкубирования посевов при 37 °С в течение 18—20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями. Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тест-бактерий. Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1:1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024- 0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл.
Определение способности S. aureus продуцировать бета-лактамазу.В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лактамазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска).
studopedia.ru
Методы определения чувствительности бактерий к антибиотикам
Так как одним из важнейших принципов правильного лечения инфекционных заболеваний является выбор антибиотика, к которому возбудитель наиболее чувствителен, перед назначением антибиотиков проводится определение чувствительности возбудителя заболевания к антибиотикам, т.е. устанавливается антибиотикограмма.
Наиболее известны 3 метода:
1. Метод бумажных дисков на питательном агаре. В чашку Петри на питательный агар делают посев микробной взвеси. Избыток жидкости удаляют пипеткой. После впитывания взвеси в агар на засеянную поверхность пинцетом наносят 5-6 разных бумажных дисков с антибиотиками, диски отличаются по цвету. Чашки с дисками ставят в термостат при 37°С на 18-20 часов. Антибиотики из дисков диффундируют в агар. По диаметру зон задержки роста исследуемой культуры судят о ее чувствительности к антибиотикам. Этот метод нельзя применять, если антибиотики плохо диффундируют в агар. Преимущество метода – можно определить чувствительность исследуемой бактериальной культуры сразу к нескольким антибиотикам.
2. Метод серийных разведений в МПБ. Готовят основной раствор антибиотика в соответствующем растворителе. Из основного раствора готовят последующие 2-хкратные разведения в бульоне. Обычно берут 12 пробирок по 1 мл МПБ в пробирке. После последовательных разведений антибиотика в МПБ, в каждую пробирку добавляют 0,1 мл взвеси клеток испытуемой бактериальной культуры, содержащей 106-107 клеток. Посевы инкубируют в термостате 18-24 ч. Результаты отмечают по наличию роста. Если есть рост бактерий – среда мутная. Если нет роста бактерий – среда прозрачная. Если среда в пробирке мутная, то в данной концентрации антибиотик не действует, если прозрачная– антибиотик действует. По последней пробирке с прозрачной средой определяют минимальную ингибирующую дозу антибиотика. Одновременно ставят контрольные пробы: 1-ый контроль (контроль бактериальной культуры) - 1 мл МПБ + взвесь бактерий без антибиотика, 2-ой контроль (контроль антибиотика) - 1 мл МПБ + антибиотик, но без взвеси бактерий. В контрольных пробирках должны быть следующие результаты: 1-ый контроль – помутнение среды (есть рост); 2-ой контроль – среда прозрачная (нет роста). Для того, чтобы узнать какое действие оказал антибиотик (бактерицидное или бактериостатическое), петлей делают посевы из пробирок на сектора ПА. Роста нет – бактерицидное действие, рост есть – бактериостатическое действие. Преимущество метода – определение минимальной концентрации антибиотика, которая ингибирует (подавляет) рост бактериальной культуры.
3. Метод «канавки»(предложен А. Флемингом). Берут чашку Петри с питательным агаром. В центре по диаметру вырезают полоску агара шириной 1 см. Затем канавку заполняют агаром, смешанным с антибиотиком. После застывания канавки перпендикулярно делают посев исследуемых культур (4-5). После инкубации в термостате чувствительность определяют по длине зоны задержки роста, чем она больше, тем культура чувствительнее и наоборот. Преимущество метода – можно определить чувствительность сразу нескольких культур к данному антибиотику.
studopedia.ru
9. Определение чувствительности микроорганизмов к антибиотикам.
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы) обычно применяют:
• Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков).Метод дисков - качественный и позволяет оценить, чувствителен или устойчив микроб к препарату.
• Методы определения минимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественныеметоды, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Есть ускоренные способы, с применением автоматических анализаторов.
Определение чувствительности бактерий к антибиотикам методом дисков. Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри. Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений. Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий, под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Определение антибиотика в крови, моче и других жидкостях организма человека.В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом - исследуемой жидкости. Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой. При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина - Е. coli. После инкубирования посевов при 37 °С в течение 18-20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями. Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тест-бактерий. Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1:1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024х0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл.
Определение способности S. aureus продуцировать бета-лактамазу. В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лактамазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска).
StudFiles.ru
Читайте также
![Методы определения чувствительности к антибиотикам Методы определения чувствительности к антибиотикам]() Методы определения чувствительности к антибиотикам
Методы определения чувствительности к антибиотикам![Автомобиль определение Автомобиль определение]() Автомобиль определение
Автомобиль определение- Актив определение
![Акт определение Акт определение]() Акт определение
Акт определение![Административное право определение Административное право определение]() Административное право определение
Административное право определение![Анкета определение Анкета определение]() Анкета определение
Анкета определение![Вопросы определения Вопросы определения]() Вопросы определения
Вопросы определения![Безработица определение Безработица определение]() Безработица определение
Безработица определение![Бетон определение Бетон определение]() Бетон определение
Бетон определение![Брак это определение в производстве Брак это определение в производстве]() Брак это определение в производстве
Брак это определение в производстве![Власть определение Власть определение]() Власть определение
Власть определение![Восприятие определение Восприятие определение]() Восприятие определение
Восприятие определение
 Методы определения чувствительности к антибиотикам
Методы определения чувствительности к антибиотикам Автомобиль определение
Автомобиль определение Акт определение
Акт определение Административное право определение
Административное право определение Анкета определение
Анкета определение Вопросы определения
Вопросы определения Безработица определение
Безработица определение Бетон определение
Бетон определение Брак это определение в производстве
Брак это определение в производстве Власть определение
Власть определение Восприятие определение
Восприятие определение