/ Таблица энтальпии сгорания и образования
17. Стандартные энтальпии образования
и стандартные энтропии некоторых веществ
|
Вещество |
Состояние |
ΔH0ƒ,298,кДж/моль |
S0298,Дж/моль∙К |
|
Ag |
к |
0 |
42,69 |
|
AgBr |
к |
– 99,16 |
107,1 |
|
AgCl |
к |
– 126,8 |
96,07 |
|
AgI |
к |
– 64,2 |
114,2 |
|
AgF |
к |
– 202,9 |
83,7 |
|
AgNO3 |
к |
– 120,7 |
140,9 |
|
Ag2O |
к |
– 30,56 |
121,7 |
|
Al |
к |
0 |
28,35 |
|
Al2O3 |
к |
– 1676 |
50,92 |
|
Al(OH)3 |
к |
– 1275,7 |
71,1 |
|
AlCl3 |
к |
– 697,4 |
167,0 |
|
Al2(SO4)3 |
к |
– 3434,0 |
239,2 |
|
As |
к |
0 |
35,1 |
|
As2O3 |
к |
– 656,8 |
107,1 |
|
As2O5 |
к |
– 918,0 |
105,4 |
|
Au |
к |
0 |
47,65 |
|
AuF |
к |
– 74,3 |
96,4 |
|
AuF3 |
к |
– 348,53 |
114,2 |
|
Au(OH)3 |
к |
– 418,4 |
121,3 |
|
AuCl |
к |
– 118,4 |
146,4 |
|
B |
к |
0 |
5,87 |
|
B2O3 |
к |
– 1264,0 |
53,85 |
|
B2H6 |
г |
31,4 |
232,9 |
|
Ba |
к |
0 |
64,9` |
|
BaO |
к |
– 558,1 |
70,3 |
|
BaCO3 |
к |
– 1219 |
112,1 |
|
Be |
к |
0 |
9,54 |
|
BeO |
к |
– 598,7 |
14,10 |
|
BeCO3 |
к |
– 981,57 |
199,4 |
|
Bi |
к |
0 |
56,9 |
|
BiCl3 |
г |
– 270,7 |
356,9 |
|
BiCl3 |
к |
– 379,1 |
189,5 |
|
Br2 |
г |
30,92 |
245,35 |
|
HBr |
г |
– 36,23 |
198,48 |
|
С (графит) |
к |
0 |
5,74 |
|
С (алмаз) |
к |
1,897 |
2,38 |
|
C |
г |
716 |
|
|
CO |
г |
– 110,5 |
197,5 |
|
CO2 |
г |
– 393,5 |
213,7 |
|
COCl2 |
г |
– 223,0 |
289,2 |
|
CS2 |
г |
115,3 |
237,8 |
|
CS2 |
ж |
87,8 |
151,0 |
|
CCl4 |
ж |
– 135,44 |
214,6 |
|
CH4 |
г |
– 74,86 |
186,19 |
|
CHO |
к |
– 1207,0 |
88,7 |
|
C2H2 |
г |
218,2 |
200,6 |
|
С2H4 |
г |
52,25 |
219,0 |
|
С2H6 |
к |
– 84,6 |
229,1 |
|
C6H6 |
ж |
49,04 |
173,2 |
|
CH3OH |
ж |
– 227,6 |
160,7 |
|
С2H5OH |
ж |
– 277,6 |
160,7 |
|
CH3COOH |
ж |
– 484,9 |
159,8 |
|
Ca |
к |
0 |
41,62 |
|
CaO |
к |
– 635,5 |
39,7 |
|
CaF2 |
к |
– 1214,0 |
68,87 |
|
CaCl2 |
к |
– 785,8 |
113,8 |
|
CaC2 |
к |
– 62,8 |
70,3 |
|
Ca3N2 |
к |
– 431,8 |
104,6 |
|
Ca(OH)2 |
к |
– 986,6 |
83,4 |
|
CaSO4 |
к |
– 1424,0 |
106,7 |
|
CaSiO3 |
к |
– 1579,0 |
87,45 |
|
Ca3(PO4)2 |
к |
– 4125,0 |
240,9 |
|
CaCO3 (кальцит) |
к |
– 1206,0 |
92,9 |
|
Cl2 |
г |
0 |
223,0 |
|
HCl |
г |
– 92,30 |
186,7 |
|
HCl |
ж |
– 167,5 |
55,2 |
|
HClO |
ж |
– 116,4 |
129,7 |
|
Cr |
к |
0 |
23,76 |
|
Cr2O3 |
к |
– 1141,0 |
81,1 |
|
Cr(CO)6 |
к |
– 1075,62 |
359,4 |
|
Cs |
к |
0 |
84,35 |
|
Cs2O |
к |
– 317,6 |
123,8 |
|
CsOH |
к |
– 406,5 |
77,8 |
|
Cu |
к |
0 |
33,15 |
|
Cu |
г |
339,32 |
166,27 |
|
Cu2O |
к |
– 167,36 |
93,93 |
|
CuO |
к |
– 162 |
42,63 |
|
Cu(OH)2 |
к |
– 444,3 |
79,50 |
|
CuF2 |
к |
– 530,9 |
84,5 |
|
CuCl2 |
к |
– 205,9 |
113,0 |
|
CuBr |
к |
– 141,42 |
142,34 |
|
CuI2 |
к |
– 21,34 |
159,0 |
|
Cu2S |
к |
– 82,01 |
119,24 |
|
CuS |
к |
– 48,5 |
66,5 |
|
СuSO4 |
к |
– 771,1 |
133,3 |
|
CuSO4∙5H2O |
к |
– 2279,4 |
300 |
|
CuСO3 |
к |
– 594,96 |
87,9 |
|
Cu(NO3)2 |
к |
– 307,11 |
193 |
|
(CuOH)2CO3 |
к |
– 1051 |
211,6 |
|
Fe |
к |
0 |
27,15 |
|
FeO |
к |
– 264,8 |
60,75 |
|
Fe2O3 |
к |
– 822,2 |
60,75 |
|
Fe3O4 |
к |
– 1117,1 |
146,2 |
|
Fe(OH)2 |
к |
– 561,7 |
88 |
|
Fe(OH)3 |
к |
– 826,6 |
105 |
|
FeS |
к |
– 100,4 |
60,29 |
|
FeS2 (пирит) |
к |
– 163,2 |
52,93 |
|
FeSO4 |
к |
– 929,47 |
121,04 |
|
FeSO4∙7H2O |
к |
– 3016 |
409,1 |
|
Fe2(SO4)3 |
к |
– 2584 |
282,8 |
|
FeCl2 |
к |
– 341,0 |
119,66 |
|
FeCl3 |
к |
– 405,0 |
130,1 |
|
FeCO3 |
к |
– 744,75 |
92,9 |
|
GeO |
к |
– 305,4 |
50,2 |
|
GeO2 |
к |
539,74 |
52,30 |
|
H2 |
г |
0 |
130,52 |
|
H2O |
г |
– 241,84 |
188,74 |
|
H2O |
ж |
– 285,84 |
69,96 |
|
H2O2 |
ж |
– 187,36 |
105,86 |
|
Hg |
к |
0 |
76,1 |
|
HgCl2 |
к |
– 230,12 |
144,35 |
|
Hg2Cl2 |
к |
– 264,85 |
185,81 |
|
I2 |
к |
0 |
116,73 |
|
I2 |
г |
62,24 |
260,58 |
|
HI |
г |
25,94 |
206,33 |
|
HIO |
ж |
– 158,9 |
24,32 |
|
K |
к |
0 |
64,35 |
|
K2O |
к |
– 361,5 |
87,0 |
|
КOH |
к |
– 425,8 |
59,41 |
|
КNO3 |
к |
– 493,2 |
123,93 |
|
KNO2 |
к |
– 370,28 |
117,17 |
|
K2SO4 |
к |
– 1433,44 |
175,73 |
|
KHSO4 |
к |
– 1158,1 |
187,89 |
|
KH |
к |
– 56,9 |
67,95 |
|
Li |
к |
0 |
28,03 |
|
Li2O |
к |
– 595,8 |
17,9 |
|
NiOH |
к |
– 487,8 |
42,81 |
|
Mg |
к |
0 |
32,55 |
|
MgO |
к |
– 601,24 |
26,94 |
|
Mg(OH)2 |
к |
– 924,66 |
63,14 |
|
MgCO3 |
к |
– 1096,21 |
65,69 |
|
MnSO4 |
к |
– 1063,74 |
112,13 |
|
N2 |
г |
0 |
191,5 |
|
N2O |
г |
81,55 |
220,0 |
|
NO |
г |
90,37 |
210,62 |
|
NO2 |
г |
33,89 |
240,45 |
|
N2O4 |
г |
9,37 |
304,3 |
|
NH3 |
г |
– 46,19 |
192,5 |
|
HNO3 |
ж |
– 173,0 |
156,16 |
|
NH4Cl |
к |
– 315,39 |
94,56 |
|
NH4OH |
ж |
– 366,69 |
179,9 |
|
Na |
к |
0 |
51,42 |
|
Na2O |
к |
– 430,6 |
71,1 |
|
NaOH |
к |
– 426,6 |
64,18 |
|
NaCl |
к |
– 410 |
72,36 |
|
Na2СO3 |
к |
– 1129,0 |
136,0 |
|
Na2SO4 |
к |
–1384,0 |
149,4 |
|
Na2SiO3 |
к |
–1518,0 |
113,8 |
|
O2 |
г |
0 |
205,03 |
|
О3 |
г |
142,3 |
238,8 |
|
P (красный) |
к |
–18,41 |
22,8 |
|
PCl3 |
г |
–277,0 |
311,7 |
|
PCl5 |
г |
–369,45 |
362,9 |
|
HPO3 |
ж |
–82,4 |
150,6 |
|
H3PO4 |
ж |
–1271,94 |
200,83 |
|
H3PO4 |
к |
– 1279 |
110, 5 |
|
Pb |
к |
0 |
64,9 |
|
PbO |
к |
–217,86 |
67,4 |
|
PbO2 |
к |
–276,86 |
76,44 |
|
PbCl |
к |
–359,2 |
136,4 |
|
PbSO4 |
к |
–918,1 |
147,28 |
|
PbS |
к |
–94,28 |
91,20 |
|
Rb |
к |
0 |
76,2 |
|
Rb2O |
к |
–330,12 |
109,6 |
|
RbOH |
к |
-413,80 |
70,7 |
|
S (ромб.) |
к |
0 |
31,88 |
|
SO2 |
г |
–296,9 |
248,1 |
|
SO3 |
г |
–395,2 |
256,23 |
|
H2S |
г |
–20,15 |
205,64 |
|
H2S |
ж |
–39,33 |
122,2 |
|
H2SO4 |
ж |
–811,3 |
156,9 |
|
H2Se |
г |
85,77 |
221,3 |
|
SiO2 |
к |
–859,3 |
42,09 |
|
Sn (белое) |
к |
0 |
51,55 |
|
Sn (серое) |
к |
– 2,1 |
44,14 |
|
SnO |
к |
–286,0 |
56,74 |
|
SnO |
к |
–580,8 |
52,34 |
|
SrO |
к |
–590,4 |
54,4 |
|
SrCO3 |
к |
–1221,3 |
97,1 |
|
H2Te |
г |
154,39 |
234,3 |
|
Zn |
к |
0 |
41,59 |
|
ZnO |
к |
–349,0 |
43,5 |
|
ZnS |
к |
–201,0 |
57,7 |
|
ZnSO4 |
к |
–978,2 |
124,6 |
18. Энтальпии сгорания некоторых веществ в стандартных условиях
|
Вещество |
∆H0298, кДж/моль |
Вещество |
∆H0298, кДж/моль |
||
|
формула |
название |
формула |
название |
||
|
CH4 C2H2 C2H4 C2H6 C6H6 C7H8 CH3OH C2H5OH C2H4(OH)2 C3H8(OH)3 C4H8O2 C4H10O CH3COOH |
Метан Ацетилен Этилен Этан Бензол Толуол Метиловый спирт Этиловый спирт Этиленгликоль Глицерин Этилацетат Диэтиловый эфир Уксусная к-та |
-890,31 -1299,63 -1410,97 -1559,88 -3267,70 -3910,28 -726,64 -1366,91 -1192,86 -1664,40 -2254,21 -2730,90 -873,79 |
C7H6O2 C6H12O6 C12H22O11 C3H9N ССl4 С6H5O2N С6H7N (ж) С5Н10 H2S C С S Н2 |
Бензойная к-та Глюкоза Сахароза Триметиламин Тетрахлорметан Нитробензол Анилин Циклопентан Сероводород Графит Алмаз Сера Водород |
-3227,54 -2815,8 -5648,0 -2442,92 -260,65 -3057,01 -3396,2 -3319,54 -517 -393,51 -395,7 -296,9 -285,83 |
StudFiles.ru
Толуол
Сюда перенаправляется запрос «Бензил». На эту тему нужна отдельная статья. ТолуолОбщие Физические свойства Термические свойства Химические свойства Классификация SMILES InChI Безопасность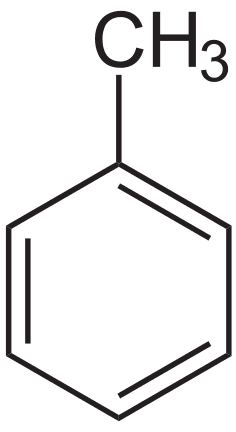 |
|
| Хим. формула | C₇H₈ |
| Молярная масса | 92,14 г/моль |
| Плотность | 0,86694 г/см³ |
| Т. плав. | −95 ℃ |
| Т. кип. | 110,6 ℃ |
| Кр. точка | 320 °C (593 K), 4299 кПа |
| Удельная теплота испарения | 364 кДж/кг |
| Растворимость в воде | 14 мг/100 мл |
| Номер CAS | 108-88-3 |
| PubChem | 1140 |
| ChemSpider | 1108 |
| Номер EINECS | 203-625-9 |
| RTECS | XS5250000 |
| ChEBI | 17578 |
| DrugBank | DB11558 |
| CC1=CC=CC=C1 | |
| 1S/C7H8/c1-7-5-3-2-4-6-7/h2-6H,1H3 | |
| NFPA 704 | 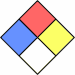 3 2 0 3 2 0 |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Толуо́л (от исп. Tolu, толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пельтье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название[1].
Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
- Взаимодействие с перманганатом калия в кислой среде:
- Взаимодействие с перманганатом калия в нейтральной среде
- Взаимодействие с галогенами на свету
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь[2][3].
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
C 6 H 6 + C H 3 B r → F e B r 3 C 6 H 5 C H 3 + H B r {\displaystyle {\mathsf {C_{6}H_{6}+CH_{3}Br{\xrightarrow[{}]{FeBr_{3}}}C_{6}H_{5}CH_{3}+HBr}}}Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»)[4].
ru.wikipedia.org
/ Химия / таблица энтропий и энтальпий_298
17. Стандартные энтальпии образования
и стандартные энтропии некоторых веществ
|
Вещество |
Состояние |
ΔH0ƒ,298,кДж/моль |
S0298,Дж/моль∙К |
|
Ag |
к |
0 |
42,69 |
|
AgBr |
к |
– 99,16 |
107,1 |
|
AgCl |
к |
– 126,8 |
96,07 |
|
AgI |
к |
– 64,2 |
114,2 |
|
AgF |
к |
– 202,9 |
83,7 |
|
AgNO3 |
к |
– 120,7 |
140,9 |
|
Ag2O |
к |
– 30,56 |
121,7 |
|
Al |
к |
0 |
28,35 |
|
Al2O3 |
к |
– 1676 |
50,92 |
|
Al(OH)3 |
к |
– 1275,7 |
71,1 |
|
AlCl3 |
к |
– 697,4 |
167,0 |
|
Al2(SO4)3 |
к |
– 3434,0 |
239,2 |
|
As |
к |
0 |
35,1 |
|
As2O3 |
к |
– 656,8 |
107,1 |
|
As2O5 |
к |
– 918,0 |
105,4 |
|
Au |
к |
0 |
47,65 |
|
AuF |
к |
– 74,3 |
96,4 |
|
AuF3 |
к |
– 348,53 |
114,2 |
|
Au(OH)3 |
к |
– 418,4 |
121,3 |
|
AuCl |
к |
– 118,4 |
146,4 |
|
B |
к |
0 |
5,87 |
|
B2O3 |
к |
– 1264,0 |
53,85 |
|
B2H6 |
г |
31,4 |
232,9 |
|
Ba |
к |
0 |
64,9` |
|
BaO |
к |
– 558,1 |
70,3 |
|
BaCO3 |
к |
– 1219 |
112,1 |
|
Be |
к |
0 |
9,54 |
|
BeO |
к |
– 598,7 |
14,10 |
|
BeCO3 |
к |
– 981,57 |
199,4 |
|
Bi |
к |
0 |
56,9 |
|
BiCl3 |
г |
– 270,7 |
356,9 |
|
BiCl3 |
к |
– 379,1 |
189,5 |
|
Br2 |
г |
30,92 |
245,35 |
|
HBr |
г |
– 36,23 |
198,48 |
|
С (графит) |
к |
0 |
5,74 |
|
С (алмаз) |
к |
1,897 |
2,38 |
|
C |
г |
716 |
|
|
CO |
г |
– 110,5 |
197,5 |
|
CO2 |
г |
– 393,5 |
213,7 |
|
COCl2 |
г |
– 223,0 |
289,2 |
|
CS2 |
г |
115,3 |
237,8 |
|
CS2 |
ж |
87,8 |
151,0 |
|
CCl4 |
ж |
– 135,44 |
214,6 |
|
CH4 |
г |
– 74,86 |
186,19 |
|
CHO |
к |
– 1207,0 |
88,7 |
|
C2H2 |
г |
218,2 |
200,6 |
|
С2H4 |
г |
52,25 |
219,0 |
|
С2H6 |
к |
– 84,6 |
229,1 |
|
C6H6 |
ж |
49,04 |
173,2 |
|
CH3OH |
ж |
– 227,6 |
160,7 |
|
С2H5OH |
ж |
– 277,6 |
160,7 |
|
CH3COOH |
ж |
– 484,9 |
159,8 |
|
Ca |
к |
0 |
41,62 |
|
CaO |
к |
– 635,5 |
39,7 |
|
CaF2 |
к |
– 1214,0 |
68,87 |
|
CaCl2 |
к |
– 785,8 |
113,8 |
|
CaC2 |
к |
– 62,8 |
70,3 |
|
Ca3N2 |
к |
– 431,8 |
104,6 |
|
Ca(OH)2 |
к |
– 986,6 |
83,4 |
|
CaSO4 |
к |
– 1424,0 |
106,7 |
|
CaSiO3 |
к |
– 1579,0 |
87,45 |
|
Ca3(PO4)2 |
к |
– 4125,0 |
240,9 |
|
CaCO3 (кальцит) |
к |
– 1206,0 |
92,9 |
|
Cl2 |
г |
0 |
223,0 |
|
HCl |
г |
– 92,30 |
186,7 |
|
HCl |
ж |
– 167,5 |
55,2 |
|
HClO |
ж |
– 116,4 |
129,7 |
|
Cr |
к |
0 |
23,76 |
|
Cr2O3 |
к |
– 1141,0 |
81,1 |
|
Cr(CO)6 |
к |
– 1075,62 |
359,4 |
|
Cs |
к |
0 |
84,35 |
|
Cs2O |
к |
– 317,6 |
123,8 |
|
CsOH |
к |
– 406,5 |
77,8 |
|
Cu |
к |
0 |
33,15 |
|
Cu |
г |
339,32 |
166,27 |
|
Cu2O |
к |
– 167,36 |
93,93 |
|
CuO |
к |
– 162 |
42,63 |
|
Cu(OH)2 |
к |
– 444,3 |
79,50 |
|
CuF2 |
к |
– 530,9 |
84,5 |
|
CuCl2 |
к |
– 205,9 |
113,0 |
|
CuBr |
к |
– 141,42 |
142,34 |
|
CuI2 |
к |
– 21,34 |
159,0 |
|
Cu2S |
к |
– 82,01 |
119,24 |
|
CuS |
к |
– 48,5 |
66,5 |
|
СuSO4 |
к |
– 771,1 |
133,3 |
|
CuSO4∙5H2O |
к |
– 2279,4 |
300 |
|
CuСO3 |
к |
– 594,96 |
87,9 |
|
Cu(NO3)2 |
к |
– 307,11 |
193 |
|
(CuOH)2CO3 |
к |
– 1051 |
211,6 |
|
Fe |
к |
0 |
27,15 |
|
FeO |
к |
– 264,8 |
60,75 |
|
Fe2O3 |
к |
– 822,2 |
60,75 |
|
Fe3O4 |
к |
– 1117,1 |
146,2 |
|
Fe(OH)2 |
к |
– 561,7 |
88 |
|
Fe(OH)3 |
к |
– 826,6 |
105 |
|
FeS |
к |
– 100,4 |
60,29 |
|
FeS2 (пирит) |
к |
– 163,2 |
52,93 |
|
FeSO4 |
к |
– 929,47 |
121,04 |
|
FeSO4∙7H2O |
к |
– 3016 |
409,1 |
|
Fe2(SO4)3 |
к |
– 2584 |
282,8 |
|
FeCl2 |
к |
– 341,0 |
119,66 |
|
FeCl3 |
к |
– 405,0 |
130,1 |
|
FeCO3 |
к |
– 744,75 |
92,9 |
|
GeO |
к |
– 305,4 |
50,2 |
|
GeO2 |
к |
539,74 |
52,30 |
|
H2 |
г |
0 |
130,52 |
|
H2O |
г |
– 241,84 |
188,74 |
|
H2O |
ж |
– 285,84 |
69,96 |
|
H2O2 |
ж |
– 187,36 |
105,86 |
|
Hg |
к |
0 |
76,1 |
|
HgCl2 |
к |
– 230,12 |
144,35 |
|
Hg2Cl2 |
к |
– 264,85 |
185,81 |
|
I2 |
к |
0 |
116,73 |
|
I2 |
г |
62,24 |
260,58 |
|
HI |
г |
25,94 |
206,33 |
|
HIO |
ж |
– 158,9 |
24,32 |
|
K |
к |
0 |
64,35 |
|
K2O |
к |
– 361,5 |
87,0 |
|
КOH |
к |
– 425,8 |
59,41 |
|
КNO3 |
к |
– 493,2 |
123,93 |
|
KNO2 |
к |
– 370,28 |
117,17 |
|
K2SO4 |
к |
– 1433,44 |
175,73 |
|
KHSO4 |
к |
– 1158,1 |
187,89 |
|
KH |
к |
– 56,9 |
67,95 |
|
Li |
к |
0 |
28,03 |
|
Li2O |
к |
– 595,8 |
17,9 |
|
NiOH |
к |
– 487,8 |
42,81 |
|
Mg |
к |
0 |
32,55 |
|
MgO |
к |
– 601,24 |
26,94 |
|
Mg(OH)2 |
к |
– 924,66 |
63,14 |
|
MgCO3 |
к |
– 1096,21 |
65,69 |
|
MnSO4 |
к |
– 1063,74 |
112,13 |
|
N2 |
г |
0 |
191,5 |
|
N2O |
г |
81,55 |
220,0 |
|
NO |
г |
90,37 |
210,62 |
|
NO2 |
г |
33,89 |
240,45 |
|
N2O4 |
г |
9,37 |
304,3 |
|
NH3 |
г |
– 46,19 |
192,5 |
|
HNO3 |
ж |
– 173,0 |
156,16 |
|
NH4Cl |
к |
– 315,39 |
94,56 |
|
NH4OH |
ж |
– 366,69 |
179,9 |
|
Na |
к |
0 |
51,42 |
|
Na2O |
к |
– 430,6 |
71,1 |
|
NaOH |
к |
– 426,6 |
64,18 |
|
NaCl |
к |
– 410 |
72,36 |
|
Na2СO3 |
к |
– 1129,0 |
136,0 |
|
Na2SO4 |
к |
–1384,0 |
149,4 |
|
Na2SiO3 |
к |
–1518,0 |
113,8 |
|
O2 |
г |
0 |
205,03 |
|
О3 |
г |
142,3 |
238,8 |
|
P (красный) |
к |
–18,41 |
22,8 |
|
PCl3 |
г |
–277,0 |
311,7 |
|
PCl5 |
г |
–369,45 |
362,9 |
|
HPO3 |
ж |
–82,4 |
150,6 |
|
H3PO4 |
ж |
–1271,94 |
200,83 |
|
H3PO4 |
к |
– 1279 |
110, 5 |
|
Pb |
к |
0 |
64,9 |
|
PbO |
к |
–217,86 |
67,4 |
|
PbO2 |
к |
–276,86 |
76,44 |
|
PbCl |
к |
–359,2 |
136,4 |
|
PbSO4 |
к |
–918,1 |
147,28 |
|
PbS |
к |
–94,28 |
91,20 |
|
Rb |
к |
0 |
76,2 |
|
Rb2O |
к |
–330,12 |
109,6 |
|
RbOH |
к |
-413,80 |
70,7 |
|
S (ромб.) |
к |
0 |
31,88 |
|
SO2 |
г |
–296,9 |
248,1 |
|
SO3 |
г |
–395,2 |
256,23 |
|
H2S |
г |
–20,15 |
205,64 |
|
H2S |
ж |
–39,33 |
122,2 |
|
H2SO4 |
ж |
–811,3 |
156,9 |
|
H2Se |
г |
85,77 |
221,3 |
|
SiO2 |
к |
–859,3 |
42,09 |
|
Sn (белое) |
к |
0 |
51,55 |
|
Sn (серое) |
к |
– 2,1 |
44,14 |
|
SnO |
к |
–286,0 |
56,74 |
|
SnO |
к |
–580,8 |
52,34 |
|
SrO |
к |
–590,4 |
54,4 |
|
SrCO3 |
к |
–1221,3 |
97,1 |
|
H2Te |
г |
154,39 |
234,3 |
|
Zn |
к |
0 |
41,59 |
|
ZnO |
к |
–349,0 |
43,5 |
|
ZnS |
к |
–201,0 |
57,7 |
|
ZnSO4 |
к |
–978,2 |
124,6 |
18. Энтальпии сгорания некоторых веществ в стандартных условиях
|
Вещество |
∆H0298, кДж/моль |
Вещество |
∆H0298, кДж/моль |
||
|
формула |
название |
формула |
название |
||
|
CH4 C2H2 C2H4 C2H6 C6H6 C7H8 CH3OH C2H5OH C2H4(OH)2 C3H8(OH)3 C4H8O2 C4H10O CH3COOH |
Метан Ацетилен Этилен Этан Бензол Толуол Метиловый спирт Этиловый спирт Этиленгликоль Глицерин Этилацетат Диэтиловый эфир Уксусная к-та |
-890,31 -1299,63 -1410,97 -1559,88 -3267,70 -3910,28 -726,64 -1366,91 -1192,86 -1664,40 -2254,21 -2730,90 -873,79 |
C7H6O2 C6H12O6 C12H22O11 C3H9N ССl4 С6H5O2N С6H7N (ж) С5Н10 H2S C С S Н2 |
Бензойная к-та Глюкоза Сахароза Триметиламин Тетрахлорметан Нитробензол Анилин Циклопентан Сероводород Графит Алмаз Сера Водород |
-3227,54 -2815,8 -5648,0 -2442,92 -260,65 -3057,01 -3396,2 -3319,54 -517 -393,51 -395,7 -296,9 -285,83 |
StudFiles.ru
Диаграмма "жидкость-пар" для смеси бензол-толуол
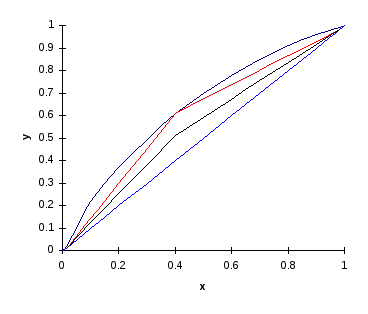
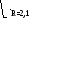
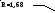
Рисунок 1
Вообще флегмовое число отражает угол наклона рабочей линии к оси абсцисс для верхней части колонны и входя в уравнение рабочей линии. Уравнение рабочей линии для верхней части колонны выглядит как:![]() (5)
(5)
yD, как впрочем и yW определяются равными xDи xWсоответственно. Иначе говоря предполагается что состав паровой и жидкой фазы одинаков как для низа так и для верха колонны. Все это можно увидеть на рисунке 1.
Минимальное флегмовое число определяется по следующей формуле:
![]() (6)
(6)
где ![]() - мольная доля спирта в паре, находящемся в равновесии с исходной смесью, определяется по y-x диаграмме .
- мольная доля спирта в паре, находящемся в равновесии с исходной смесью, определяется по y-x диаграмме .
Тогда:
![]()
Рабочее значение флегмового числа примем равным 2,1. Для определения рабочего флегмового числа существует множество рекомендаций, мы их упускаем, но их можно найти в [3].
2.1.3 Построение рабочей линии на диаграмме “жидкость - пар”.
Рабочая линия процесса ректификации, в отличие от процесса абсорбции, представляет собой совокупность рабочих линий для верхней и для нижней части колонны и характеризуется изломом в точке соответствующей составу питательной смеси.
Для верхней части колонны можно воспользоваться уравнением (5), а для нижней части колонны существует уравнение:
![]() (6)
(6)
Вид рабочей линии представлен на все том же рисунке 1.
2.1.4 Определение среднего массового расхода по жидкости
Средние массовые расходы по жидкости для верхней и нижней частей колонны определяются из соотношений :
![]() (7)
(7)
![]() (8)
(8)
где МP и МF - мольные массы дистиллята и исходной смеси, ![]()
МВ и МН - мольные массы жидкости в верхней и нижней частях, ![]()
Мольная масса жидкости в верхней и нижней частях колонны соответственно равна :
![]() (9)
(9)
![]() (10)
(10)
где Мб и Мт - мольные массы бензола и толуола
xср.в и xср.н - средний мольный состав жидкости соответственно в верхней и нижней частях колонны:
![]()
![]()
![]()
![]()
Тогда
![]()
![]()
![]()
![]()
Аналогично находится мольная масса исходной смеси:
![]()
![]()
Мольную массу дистиллята можно принять равной мольной массе бензола.
Подставив результаты соотношения в (7) и (8) получаем:
![]()
![]()
![]()
![]()
2.1.5 Определение среднего массового расхода по пару
Средние массовые потоки пара в верхней и нижней частях колонны соответственно равны :
![]() (11)
(11)
![]() (12)
(12)
где ![]() и
и![]() - средние мольные массы паров в верхней и нижней частях колонны:
- средние мольные массы паров в верхней и нижней частях колонны:
![]() (13)
(13)
![]() (14)
(14)
где средние значения состава паровой фазы рассчитываются аналогично жидкой фазе и равны:
![]()
![]()
![]()
![]()
Тогда из формул (13) и (14) следует
![]()
![]()
![]()
![]()
Подставив результаты в (11) и (12) получаем:
![]()
![]()
![]()
![]()
2.2 Скорость пара и диаметр колонны
На этой стадии необходимо выбрать тип тарелки. Поскольку предполагается, что жидкость не содержит взвешенных частиц выберем используем ситчатые тарелки.
Допустимая скорость в верхней и нижней части колонны определяется по формуле:
![]() (15)
(15)
Поскольку плотности бензола и толуола близки, то плотность жидкой фазы может быть приближенно определена как 796 кг/м3.
Средняя плотность пара для нижней и для верхней части колонны может быть определена по формуле:
![]() (16)
(16)
где t- температура для верхней или для нижней части колонны.
Температура в колонне, в свою очередь, определяется по диаграмме t- x,y, которую можно увидеть на рисунке 2.
StudFiles.ru
Бензол: формула. Бензол: электронное строение, свойства
Ароматические углеводороды составляют важную часть циклического ряда органических соединений. Простейшим представителем таких углеводородов является бензол. Формула этого вещества не только выделила его из ряда остальных углеводородов, но и дала толчок в развитии нового направления органической химии.
Открытие ароматических углеводородов
Ароматические углеводороды были открыты в начале 19 века. В те времена наиболее распространенным топливом для уличного освещения являлся светильный газ. Из его конденсата великий английский физик Майкл Фарадей выделил в 1825 году три грамма маслянистого вещества, подробно описал его свойства и назвал так: карбюрированный водород. В 1834 году немецкий ученый, химик Митчерлих, нагревая бензойную кислоту с известью, получил бензол. Формула, по которой протекала данная реакция, представлена ниже:
C6 H5 COOH + CaO сплавление C6 H6 + CaCO3.
В то время редкую бензойную кислоту получали из смолы бензое, которую могут выделять некоторые тропические растения. В 1845 году новое соединение было обнаружено в каменноугольной смоле, которая являлась вполне доступным сырьем для получения нового вещества в промышленных масштабах. Другим источником бензола является нефть, полученная в некоторых месторождениях. Чтобы обеспечить потребность промышленных предприятий в бензоле, его получают также путем ароматизации некоторых групп ациклических углеводородов нефти.
Современный вариант названия предложил немецких ученый Либих. Корень слова «бензол» следует искать в арабских языках - там оно переводится как «ладан».
Физические свойства бензола
Бензол является бесцветной жидкостью со специфическим запахом. Это вещество кипит при температуре 80,1 оС, отвердевает при 5,5 оС и превращается при этом в белый кристаллический порошок. Бензол практически не проводит тепло и электричество, плохо растворяется в воде и хорошо – в различных маслах. Ароматические свойства бензола отражают суть структуры его внутреннего строения: относительно устойчивое бензольное ядро и неопределенный состав.
Химическая классификация бензола

Бензол и его гомологи - толуол и этилбензол - представляют собой ароматический ряд циклических углеводородов. Строение каждого из этих веществ содержит распространенную структуру, названную бензоловым кольцом. Структура каждого из вышеперечисленных веществ содержит особую циклическую группировку, созданную шестью атомами углерода. Она получила название бензольного ароматического ядра.
История открытия
Установление внутреннего строения бензола растянулось на несколько десятилетий. Основные принципы строения (кольцевая модель) были предложены в 1865 году химиком А. Кекуле. Как рассказывает легенда, немецкий ученый увидел формулу этого элемента во сне. Позднее было предложено упрощенное написание структуры вещества, называемого так: бензол. Формула этого вещества представляет собой шестиугольник. Символы углерода и водорода, которые должны быть расположены в углах шестиугольника, опускаются. Таким образом, получается простой правильный шестиугольник с чередующимися одинарными и двойными линиями на сторонах. Общая формула бензола представлена на рисунке ниже.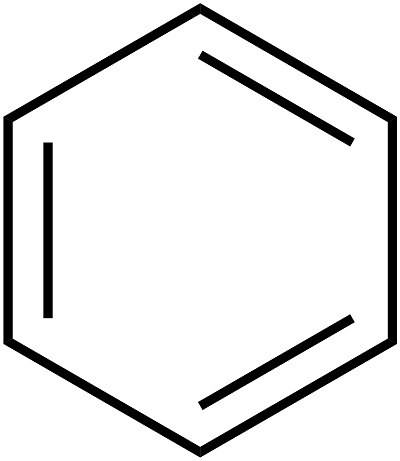
Ароматические углеводороды и бензол
Химическая формула этого элемента позволяет утверждать, что для бензола реакции присоединения нехарактерны. Для него, как и для других элементов ароматического ряда, типичны реакции замещения атомов водорода в бензольном кольце.
Реакция сульфирования
При обеспечения взаимодействия концентрированной серной кислоты и бензола, повышая температуру реакции, можно получить бензосульфокислоту и воду. Структурная формула бензола в этой реакции выглядит следующим образом: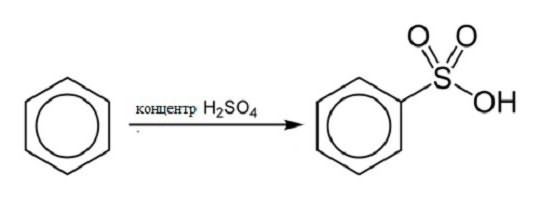
Реакция галогенирования
Бром или хром в присутствии катализатора взаимодействует с бензолом. При этом получаются галогенопроизводные. А вот реакция нитрирования проходит с использованием концентрированной азотной кислоты. Конечным итогом реакции является азотистое соединение:
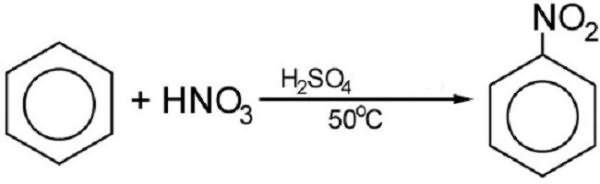
С помощью нитрирования получают известное всем взрывчатое вещество – тротил, или тринитотолуол. Мало кто знает, что в основе тола лежит бензол. Многие другие нитросоединения на основе бензольного кольца также могут быть использованы как взрывчатые вещества
Электронная формула бензола
Стандартная формула бензольного кольца не совсем точно отражает внутренне строение бензола. Согласно ей, бензол должен обладать тремя локализованными п-связями, каждая из которых должна взаимодействовать с двумя атомами углерода. Но, как показывает опыт, бензол не обладает обычными двойными связями. Молекулярная формула бензола позволяет увидеть, что все связи в бензольном кольце равноценны. Каждая из них имеет длину около 0,140 нм, что является промежуточным значением между длиной стандартной простой связи (0,154 нм) и двойной этиленовой связи (0,134 нм). Структурная формула бензола, изображенная с чередованием связей, несовершенна. Более правдоподобна трехмерная модель бензола, которая выглядит так, как показано на картинке ниже.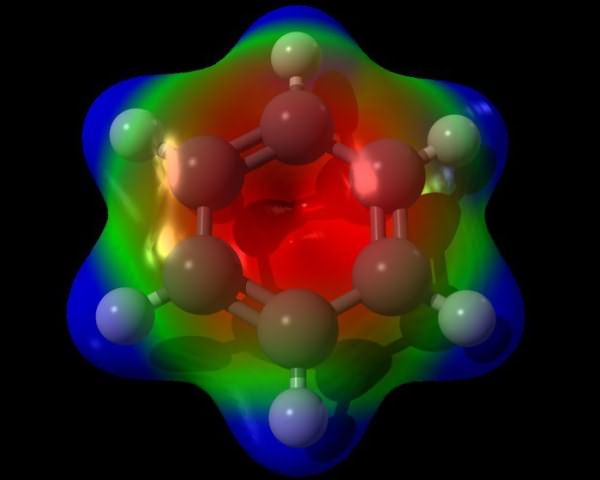 Каждый из атомов бензольного кольца находится в состоянии sp2-гибридизации. Он затрачивает на образование сигма-связей по три валентных электрона. Эти электроны охватывают два соседних атома углевода и один атом водорода. При этом и электроны, и связи С-С, Н-Н находятся в одной плоскости.
Каждый из атомов бензольного кольца находится в состоянии sp2-гибридизации. Он затрачивает на образование сигма-связей по три валентных электрона. Эти электроны охватывают два соседних атома углевода и один атом водорода. При этом и электроны, и связи С-С, Н-Н находятся в одной плоскости.
Четвертый валентный электрон образует облако в форме объемной восьмерки, расположенное перпендикулярно плоскости бензольного кольца. Каждое такое электронное облако перекрывается над плоскостью бензольного кольца и непосредственно под ней с облаками двух соседних атомов углерода.
Плотность облаков п-электронов этого вещества равномерно распределена между всеми углеродными связями. Таким путем образуется единое кольцевое электронное облако. В общей химии такая структура получила название ароматического электронного секстета.
Равноценность внутренних связей бензола
Именно равноценностью всех граней шестиугольника объясняется выравненность ароматических связей, обуславливающих характерные химические и физические свойства, которыми обладает бензол. Формула равномерного распределения п-электронного облака и равноценность всех его внутренних связей показана ниже.
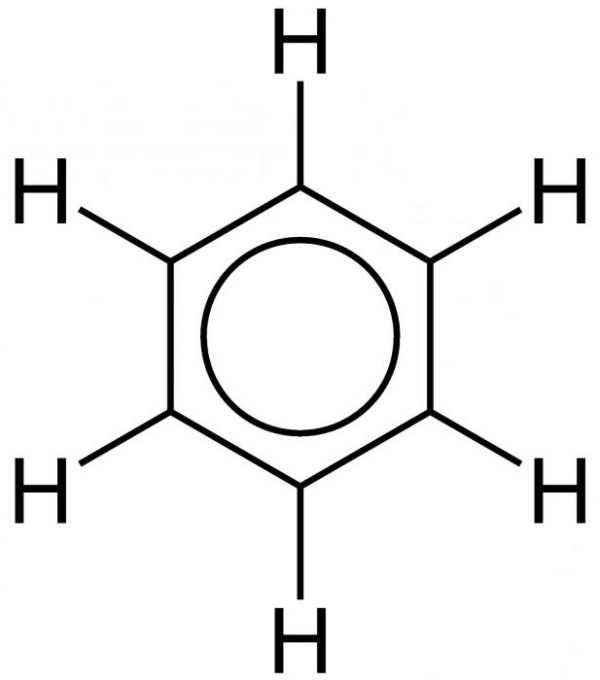
Как видно, вместо чередующихся одинарных и двойных черт внутреннюю структуру изображают в виде окружности.
Сущность внутренней структуры бензола дает ключ к пониманию внутреннего строения циклических углеводородов и расширяет возможности практического применения этих веществ.
syl.ru
Формула толуола: что такое толуол и как его получить?
Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— CnH2n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей.
Что такое толуол?
 Один из важнейших аренов — толуол — представляет собой метильное производное бензола. Нерастворимая в воде бесцветная жидкость обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей.
Один из важнейших аренов — толуол — представляет собой метильное производное бензола. Нерастворимая в воде бесцветная жидкость обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей.
Химическая формула толуола - C7H8 - может быть записана по-другому: C6H5–CH3. В этом случае количество атомов остается таким же, но заметно отличие от бензола, которое заключается в радикале — метиле.
Используя другие принципы номенклатуры, соединение называют метилбензолом и фенилметаном. Это тот же толуол, общая формула которого C7H8. Но в первом случае акцент делается на том, что один атом водорода из тех, что связаны с углеродом бензольного кольца, замещен на радикал метил. Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода.
Строение молекулы
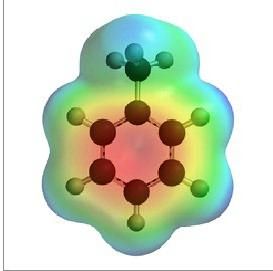 Состав органического вещества, состоящего только из атомов углерода и водорода, отражает формула толуола. Шаростержневые и объемные модели дают представление о строении молекулы соединения, ее отличии от веществ того же гомологического ряда. Есть сходство между толуолом и бензолом, которое заключается в наличии кольца из 6 атомов углерода, находящихся в состоянии sp2-гибридизации. Каждый из них образует три сигма-связи с соседними частицами (двумя атомами углерода и одним водорода). Перпендикулярно кольцу возникает единая электронная система из оставшихся негибридных p-орбиталей (по одной у шести атомов углерода). В результате приобретает значительную прочность и устойчивость весь цикл, а значит, и вещество толуол. Структурная формула соединения включает седьмой углерод из метильной группы, который находится в состоянии sp3-гибридизации. Он связан с тремя атомами водорода, а четвертую связь затрачивает на соединение с одним углеродом в бензольном кольце.
Состав органического вещества, состоящего только из атомов углерода и водорода, отражает формула толуола. Шаростержневые и объемные модели дают представление о строении молекулы соединения, ее отличии от веществ того же гомологического ряда. Есть сходство между толуолом и бензолом, которое заключается в наличии кольца из 6 атомов углерода, находящихся в состоянии sp2-гибридизации. Каждый из них образует три сигма-связи с соседними частицами (двумя атомами углерода и одним водорода). Перпендикулярно кольцу возникает единая электронная система из оставшихся негибридных p-орбиталей (по одной у шести атомов углерода). В результате приобретает значительную прочность и устойчивость весь цикл, а значит, и вещество толуол. Структурная формула соединения включает седьмой углерод из метильной группы, который находится в состоянии sp3-гибридизации. Он связан с тремя атомами водорода, а четвертую связь затрачивает на соединение с одним углеродом в бензольном кольце.
Структурные формулы метилбензола
Электронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества.
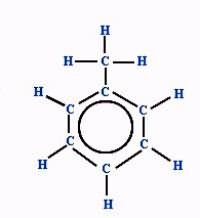
Упрощенная формула толуола - шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце.
Получение метилбензола в лаборатории и промышленности
В лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй использовал толуанский бальзам, извлеченный из южноамериканского дерева Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол. В настоящее время значительное количество метилбензола дает перегонка нефти и каменноугольной смолы с последующей очисткой. В процессе коксования толуол извлекается из коксового газа. При синтезе стирола он выделяется как побочный продукт реакции бензола и этилена. В лаборатории и промышленности получение толуола проводится разными методами.
- Дегидроциклизация ациклических углеводородов. Толуол получают из гептана в присутствии катализатора при температуре 300 C°.
- Алкилирование бензола, которое получило название реакция Фриделя-Крафтса. Проводится в присутствии катализатора AlCl3 или других катализаторов: С6Н5–Н + СН3Cl = С6Н5–СН3 + HCl.
- Взаимодействие с бромбензолом: С6Н5–Br + СН3–Br + 2Na = С6Н5–СН3 + 2NaBr.
- Смешивание цинка и крезола: C6H4CH3OH + Zn = C6H5CH3 + ZnO.
- Обработка толуолсульфоновой кислоты.
Физические свойства метилбензола
 Толуол, структурная формула которого содержит бензольное ядро, проявляет физические свойства, типичные для ароматических соединений.
Толуол, структурная формула которого содержит бензольное ядро, проявляет физические свойства, типичные для ароматических соединений.
- Прозрачная бесцветная жидкость издает запах краски.
- Затвердевает метилбензол при низких температурах и начинает плавиться в точке –93 °C.
- Температура кипения толуола составляет 110,63 °C. Плотность вещества — 0,8669 г/мл.
- Растворимость метилбензола в воде при температуре 20°С — 0,47 г/л. Молярная масса вещества M (C7H8) = 92,14 г/моль.
Химические свойства толуола: окисление
Особенности всех аренов определяются химически устойчивым циклом из шести атомов углерода. Формула толуола — это бензольное кольцо, которое формально является ненасыщенным, и радикал метил. Ароматические углеводороды по свойствам близки с алкенами, для которых характерны реакции присоединения. Но атомы водорода в молекулах бензола и его гомологов могут участвовать в реакциях замещения, что сближает арены и алканы. Толуол является более реакционноспособным, чем бензол. Для вещества характерны реакции окисления.
- Горение, которое сопровождается выделением углекислого газа и образованием воды: C7H8 + 9O2 = 7CO2 + 4H2O.
- При взаимодействии толуола с перманганатом калия происходит окисление метильной группы в боковой цепи молекулы вещества до карбоксила. В результате реакции получается бензойная кислота.
Химические реакции ароматического ядра толуола
 Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.
Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.- Нитрование метилбензола осуществляется смесью, состоящей из концентрированных азотной и серной кислот. Нитрогруппа в толуоле может занимать орто- и пара-положение. Реакция идет по механизму электрофильного замещения. При высокой температуре образуется взрывчатое вещество тринитротолуол (тротил).
- Гидрирование водородом на катализаторе приводит к деароматизации и получению метилциклогексана: C7H8 + 3H2 = C7H14.
- Хлорирование при сильном нагревании или под действием УФ-излучения завершается образованием гексахлорциклогексана.
Применение метилбензола
Толуол широко используется в качестве исходного вещества в органическом синтезе. Он является необходимым материалом в производстве многих веществ. Применение толуола:
- получение красителей;
- изготовление пятновыводителей, моющих средств;
- производство взрывчатого вещества тротила;
- использование в качестве растворителя клеев, красок, синтетических отдушек и чистящих средств;
- производство красок для строительных работ;
- выпуск продукции для ногтей;
- производство фармацевтических препаратов;
- повышение октанового числа топлива;
- органический синтез бензойной кислоты, бензальдегида, бензилхлорида, сахарина, бензилового спирта и других веществ;
Толуол выступает в качестве промышленного растворителя в химчистках, используется в процессе дубления кож. Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений.

Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Заключение
Толуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
- при сжигании нефти, разных видов топлива;
- в действующих вулканах;
- в лесных пожарах;
- при использовании растворителей и красок.
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами.
fb.ru
Бензол это:
Бензол Бензол Общие Свойства Опасность Близкие вещества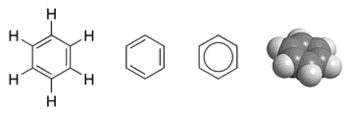 |
|
| Другие названия | фен (Лоран, 1837), фениловый водород, бензен |
| Молекулярная формула | C6H6 |
| SMILES | c1ccccc1 C1=CC=CC=C1 |
| Молярная масса | 78,11 г/моль |
| Вид | Синяя жидкость |
| Регистрационный номер CAS | 71-43-2 |
| ГОСТ | 8448-78 |
| Плотность и фазовое состояние | 0,8786 г/см³=878,6 кг/м³, жидкость |
| Растворимость в воде | 1,79 г/л при 25�°C |
| Температура плавления | 5,5�°C |
| Температура кипения | 80,1�°C |
| Вязкость | 0,652 П при 20�°C |
| Описание | Токсичен, опасен для окружающей среды, огнеопасен |
| Температура воспламенения паров | −11�°C |
| Температура самовозгорания | 562�°C |
| Близкие углеводороды | нафталин циклогексан |
| Производные | толуол |
| Если не указано другое, параметры даны для 25�°C, 100 кПа | |
Бензо́л (C6H6, PhH)�— органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен.
Содержание
|
История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной 1651 году[1]. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол�— при сухой перегонке кальциевой соли бензойной кислоты�— и немецкий физик-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К шестидесятым годам XIX-го века было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их�— CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную�— циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода[2]. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось на тот момент наиболее полно описать свойства бензола. [3]
Физические свойства
Бензол (жидкий)Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5�°C, температура кипения = 80,1�°C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25�°C (91�% бензола). Растворимость в воде 1,79 г/л (при 25�°C).
Химические свойства
Для бензола характерны реакции замещения�— бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с хлором в присутствии катализатора:
С6H6 + Cl2 -(FeCl3)→ С6H5Cl + HCl образуется хлорбензол
Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена.
Cl-Cl + FeCl3 → Clઠ-[FeCl4]ઠ+
С6H6 + Clઠ--Clઠ+ + FeCl3 → [С6H5Cl + FeCl4] → С6H5Cl + FeCl3 + HCl
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения.
С6H6 + 3Cl2 -(освещение)→ C6H6Cl6 образуется смесь изомеров гексахлорциклогексана
видео
- Взаимодействие с бромом (чистый):
С6H6 + Br2 -(FeBr3 или AlCl3)→ С6H5Br + HBr образуется бромбензол
видео
- Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя-Крафтса):
С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl образуется этилбензол
С6H6 + HNO3 -(H2SO4)→ С6H5NO2 + H2O
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6), но в отличие от углеводородов ряда этилена C2H4 проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Производство
На сегодняшний день существует три принципиально различных способа производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 1�%. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60�% от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол�— методом гидродеалкилирования;
- смесь бензола и ксилолов�— методом диспропорционирования;
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50�% бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
Тримеризация ацетилена
При пропускании ацетилена при 400°C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды:
3С2Н2 → С6H6
Применение
Значительная часть получаемого бензола используется для синтеза других продуктов:
- около 50�% бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25�% бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15�% бензола гидрируют в циклогексан;
- около 10�% бензола расходуется на производство нитробензола;
- 2—3�% бензола превращают в линейные алкилбензолы;
- приблизительно 1�% бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1�%.
Биологическое действие
При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался.
В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии и анемии. Сильный канцероген.
Бензол и токсикомания
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Ссылки
- Энциклопедический словарь юного химика / Сост. В.�А.�Крицман, В.�В.�Станцо.�— М.: Педагогика, 1982.�— 368 с., ил.
- Настольная книга учителя химии 10 класс/О.�С.�Габриелян, И.�Г.�Остроумов.�— М.:Дрофа, 2004�г.
- Лорен Грэхэм «Естествознание, философия и науки о человеческом поведении в Советском Союзе, Глава IX. Химия»
- Свойства и токсичность бензола
- ГОСТ 9572-93. Бензол нефтяной. Технические условия.
Примечания
- ↑ Furni novi philosophici, sive Descriptio artis distillatoriæ novæ per Joannem Rudolphum Glauberum. Amsterodam, 1651 // OpenLibraryющкп
- ↑ Серия «100 великих», Дмитрий Самин, 100 великих научных открытий, Основы мироздания, Бензол
- ↑ Габриелян О. С., Остроумов И. Г. «Настольная книга учителя химии�— 10 класс»
| Метан �• Этан �• Пропан �• Бутан �• Пентан �• Гексан �• Гептан �• Октан �• Нонан �• Декан �• Ундекан �• Додекан �• Тридекан �• Тетрадекан �• Гексадекан �• Эйкозан ... |
| Этилен �• Пропен �• Бутен �• Пентен �• Гексен �• Гептен �• Октен ... |
| Ацетилен �• Пропин �• Бутин |
| Пропадиен �• Бутадиен �• Изопрен |
| Винилацетилен�• Диацетилен |
| Циклопропан �• Циклобутан �• Циклопентан �• Циклогексан �• Декалин �• Индан |
| Бензол �• Толуол �• Диметилбензолы �• Этилбензол �• Пропилбензол �• Кумол �• Стирол �• Фенилацетилен �• Индан �• Циклобутадиен �• Дифенил �• Дифенилметан �• Трифенилметан �• Тетрафенилметан |
| Нафталин �• Антрацен �• Пентацен �• Фенантрен �• Пирен �• Бензпирен �• Азулен �• Хризен |
- Ароматические углеводороды
- Нефтепродукты
- Растворители
- Психоактивные вещества
Wikimedia Foundation. 2010.
dic.academic.ru
Читайте также
![Закон гука определение и формула Закон гука определение и формула]() Закон гука определение и формула
Закон гука определение и формула![Укажите формулу классического определения вероятности Укажите формулу классического определения вероятности]() Укажите формулу классического определения вероятности
Укажите формулу классического определения вероятности![Формула определения мощности Формула определения мощности]() Формула определения мощности
Формула определения мощности![Формула определения длины окружности Формула определения длины окружности]() Формула определения длины окружности
Формула определения длины окружности![Закон джоуля ленца формула и определение Закон джоуля ленца формула и определение]() Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение![Закон ампера определение и формула Закон ампера определение и формула]() Закон ампера определение и формула
Закон ампера определение и формула![Акт определение Акт определение]() Акт определение
Акт определение- Актив определение
![База данных определение База данных определение]() База данных определение
База данных определение![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Власть определение Власть определение]() Власть определение
Власть определение- Выберите один из вариантов определения истины это
 Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.
Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr. Закон гука определение и формула
Закон гука определение и формула Укажите формулу классического определения вероятности
Укажите формулу классического определения вероятности Формула определения мощности
Формула определения мощности Формула определения длины окружности
Формула определения длины окружности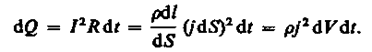 Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение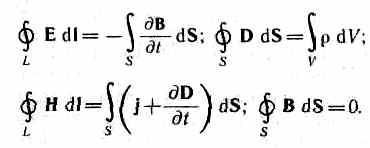 Закон ампера определение и формула
Закон ампера определение и формула Акт определение
Акт определение База данных определение
База данных определение Болезнь определение
Болезнь определение Власть определение
Власть определение