/ алгоритм 8 определение резус-фактора
Определение резус-фактора со стандартной сывороткой анти-резус.
1Вступительное слово: Мы проводим определение группы крови со стандартной сывороткой анти-резус в процедурном кабинете по назначению врача. На мне шапочка, очки, маска, халат, фартук, перчатки. Руки предварительно обработаны гигиеническим способом.
2 Оснащение:
-
Стандартная сыворотка анти-резус
-
Стерильная пробирка
-
Исследуемая кровь ( в пробирке)
-
Физиологический раствор ( в пробирке)
-
Стерильные пипетки 2 шт
-
Ёмкость с 3% раствором хлорамина
3 Техника манипуляции:
-
Внести пипеткой в пробирку две капли сыворотки анти-резус
-
Внести отдельной пипеткой одну каплю крови
-
Вращать между ладонями 5 мин
-
Внести 1 каплю физраствора в случае если наблюдается агглютинация.
-
Встряхнуть пробирку, наблюдать агглютинацию 5 мин.
-
Форма ответа: при определении резус фактора со стандартной сывороткой анти-резус..
-
Агглютинация не наблюдается – резус фактор отрицательный
-
Агглютинация наблюдается – резус фактор положительный
-
После проведения манипуляции все использованные предметы замачиваются в емкости с трехпроцентным раствором хлорамина.
4 Возможные ошибки:
Грубые ошибки:
-
Не использование средств защиты медработника.
-
Нарушение пропорции сыворотки и крови 2:1
-
Не соответствие картины агглютинации заключению о резус пренадлежности.
-
Не продезинфицированы предметы контактировавшие с кровью
Не грубые ошибки:
-
Время ожидания агглютинации менее 5 мин.
-
Не внесен физраствор в случае наблюдаемой агглютинации.
-
Выполнение манипуляции «на весу».
5 Критерии оценивания:
Сдал – отсутствие грубых ошибок, наличие не более двух не грубых ошибок.
Не сдал – наличие грубых ошибок, наличие более двух не грубых ошибок.
При совершении грубой ошибки преподаватель может попросить повторить соответствующий этап манипуляции. Если ошибка повторяется – не сдал. Допускается не более одного повторения.
StudFiles.ru
Определение резус фактора экспресс методом с помощью стандартного универсального реагента без подогрева в пробирке
Для определения резус-фактора может быть использована свежая не свернувшаяся кровь, взятая из пальца непосредственно перед исследованием, или консервированная, без всякой предварительной обработки, а также эритроциты из пробирки после образования сгустка и отстаивания сыворотки.
Техника определения.
- 1мл стандартного универсального реагента (антирезусная сыворотка группы AB(IV)+33% раствор полиглюкина);
-1мл исследуемой крови(эритроцитов)
На дно пробирки внести 1 каплю стандартного универсального реагента и 1 каплю исследуемой крови (или эритроцитов).
Содержимое пробирки перемешать встряхиванием и затем медленно поворачивать, наклоняя пробирку почти до горизонтали таким образом, чтобы содержимое растекалось по её стенкам. после 3-минутного покачивания ,
для исключения неспецифической агрегации эритроцитов в пробирку добавить 2-3мл физиологического раствора хлористого натрия и перемешать, не взбалтывая, путём 2-3-х кратного перевёртывания пробирки. Оценку производить визуально.
Оценка результата.
Резус-(+) -наличие агглютинации в виде крупных хлопьев из эритроцитов на фоне просветлённой жидкости .
Резус-(-) -отсутствие агглютинации (в пробирке гомогенно окрашенная жидкость).
Определение резус-фактора с помощью моноклонального реагента (цоликлон анти-d , анти-d супер).
Цоликлон анти-D супер выпускается во флаконах по 2,5 или 10 мл (1 мл содержит 10 доз). Срок хранения — 1 год в холодильнике при t 2~8 °С. Вскрытый флакон можно хранить в холодильнике в течение месяца в закрытом виде
Наносят большую каплю (около 0,1 мл) реагента на пластинку или планшет.
Рядом помещают маленькую каплю (0,01-0,05 мл) исследуемой крови и смешивают кровь с реагентом.
Реакция агглютинации начинает развиваться через 10-15 сек, четко выраженная агглютинация наступает через 30-60 сек.
Результаты реакции считывают через 3 мин.
Тарелку после смешивания реагента с кровью рекомендуется покачивать не сразу, а через 20-30 сек, что позволяет за это время развиться более полной крупнолепестковой агглютинации.
Метод агглютинации на чашках Петри.
- исследуемые эритроциты;
-две серии стандартных сывороток антирезус всех групп системы АВО;
-контрольные образцы резус-положительных и резус-отрицательных эритроцитов:
-водяная баня с постоянной температурой 46-48 С°
-чашки Петри
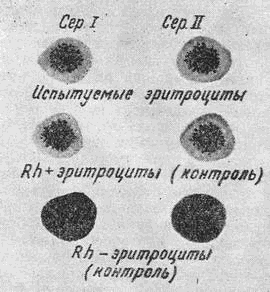 В чашку Петри наносят по 2 капли антирезусной сыворотки, слева - одной серии, справа - другой в 3 ряда для 3 исследований. В каждую серию прибавляют по 1капле эритроцитов (1.исследуемые, 2.контрольные Rh-положительные и 3.контрольные Rh-отрицательные). После смешивания (стеклянными палочками) сывороток в каждой точке с добавленными эритроцитами чашку помещают в водяную баню при t° 46—48° на 7—10 мин, после чего рассматривают в проходящем свете.
В чашку Петри наносят по 2 капли антирезусной сыворотки, слева - одной серии, справа - другой в 3 ряда для 3 исследований. В каждую серию прибавляют по 1капле эритроцитов (1.исследуемые, 2.контрольные Rh-положительные и 3.контрольные Rh-отрицательные). После смешивания (стеклянными палочками) сывороток в каждой точке с добавленными эритроцитами чашку помещают в водяную баню при t° 46—48° на 7—10 мин, после чего рассматривают в проходящем свете.
Наличие агглютинации свидетельствует о положительном результате, отсутствие ее - об отрицательном. Для контроля в этом методе используют заведомо Rh-отрицательные и Rh-положительные эритроциты.
Метод агглютинации с 10% желатином:

Реакция конглютинации с желатиной обычно проводится в пробирках емкостью 8—10 мл. В штатив устанавливают 2 ряда пробирок для двух различных серий стандартной сыворотки. В контрольные пробирки каждого ряда вводят по 1 капле стандартных резус-положительных и резус-отрицательных эритроцитов, в остальные пары пробирок — исследуемые эритроциты. Исследование можно проводить как с отмытыми, так и с неотмытыми эритроцитами.
Затем в каждую пробирку добавляют по одной капле подогретой до разжижения желатины (10% раствор) и по одной капле стандартной сыворотки. Содержимое пробирок смешивают путем встряхивания и помещают в водяную баню при t° 46—48° на 5 мин., по истечении которых в каждую пробирку доливают 5—8 мл подогретого до t° 46—48° физиологического раствора NaCl и рассматривают на свет, определяя наличие или отсутствие агглютинации (рис. 2).
Метод агглютинации в солевой среде.
При исследовании сывороткой, содержащей полные антитела, применяют метод агглютинации в солевой среде в маленьких пробирках (высотой 2—2,5 см, диаметром 0,5 — 0,6 см).
В штатив устанавливают 2 ряда пробирок (по количеству исследуемых образцов и по 2 для контроля), в которые вводится по 2 капли стандартной сыворотки и по 1 капле 2% взвеси эритроцитов, предварительно дважды отмытых физиологическим раствором NaCl.
Содержимое пробирок встряхивают и помещают в термостат при t° 37° на 1 час.
О резус-принадлежности судят по форме осадка, который рассматривают через лупу с 5—7-кратным увеличением над источником света, закрытым матовым стеклом. Результаты учитывают в зависимости от наличия или отсутствия агглютинации в исследуемых эритроцитах после проверки контрольных образцов.
studopedia.ru
Техника постановки пробы на резус совместимость с полиглюкином
Цель:определить совместимость донорской крови с кровью реципиента по резус принадлежности.
Показания:гемотрансфузия.
Приготовить:донорская кровь, 33% раствора полиглюкина, сыворотка крови реципиента, стеклянные палочки, пипетки, чашка Петри, шприц, игла, стерильные марлевые шарики, спирт, стерильный пинцет, стерильные перчатки, песочные часы, водяная баня.
Алгоритм действия:
- На дно пробирки внести 2 капли сыворотки больного, 1 каплю крови донора и 1 каплю 33% полиглюкина;
- Встряхнуть пробирку;
- Пробирку наклонить почти горизонтально и медленно поворачивать вокруг оси в течении 5 минут;
- Долить в пробирку 3-4 мл изотонического раствора хлорида натрия;
- Перемешать путем 2-3 кратного переворачивания пробирки ( не взбалтывать!);
- Посмотреть на свет и оценить результат;
- Если есть реакция агглютинации на фоне просветленной жидкости, то кровь переливать нельзя!;
- Если агглютинации не произошла, то реакция отрицательная и кровь переливать можно.
Примечание: температура воздуха должна быть в пределах 15- 25о С для профилактики ложной агглютинации.
Техника постановки биологической пробы
Цель: для определения совместимости крови донора и реципиента.
Показания:гемотрансфузия.
Приготовить:донорская кровь, систему для переливания крови, стерильные марлевые шарики, спирт, стерильный пинцет, стерильные перчатки.
Алгоритм действия:
- Перелить струйно 10-15 мл крови или кровезаменителей внутривенно;
- Закрыть систему на 3 минуты;
- Оценить состояние пациента;
- Перелить струйно 10-15 мл крови или кровезаменителей внутривенно;
- Закрыть систему на 3 минуты;
- Оценить состояние пациента;
- Перелить струйно 10-15 мл крови или кровезаменителей внутривенно;
- Оценить состояние пациента.
Примечание:При появлении болей в животе, груди, пояснице, рвоте, головной боли, одышке, тахикардии, сыпи на коже – кровь или кровезаменители вводить нельзя!
studopedia.ru
34. Оказание помощи врачу при наложении лейкопластырного скелетного вытяжения и вытяжения с помощью петли Глиссона
-
Уложить пациента на горизонтальную поверхность кровати с системой блоков и грузом в изголовье
-
Закрепить петлю Глиссона на голове либо из лейкопластыря сформировать петлю в основании черепа так, чтобы она фиксировалась у основания черепа (под подбородком и под большими затылочными буграми)
-
Прикрепить груз весом 6 кг (вес груза зависит от вида повреждения и определяется врачом)
35. Применение эластичных бинтов и чулок на нижние конечности
Эластичный бинт
-
Накладывать утром для предупреждения кровенаполнения и растяжения вен
-
Придать ноге возвышенное положение под углом 45 град.
-
Первые туры сделать у основания пальцев
-
Далее по спирали бинтовать до паховой складки
-
Туры должны оказывать умеренное давление на мягкие ткани; не должны вызывать неприятные ощущения; пальцы на стопе должны быть розовыми
36. Применение съемного бандажа, корсета
-
Предназначением бандажа, корсета является фиксация части туловища в функциональном состоянии, предупреждение осложнений, связанных с анатомическими дефектами тела, приводящими в отсутствии бандажа или корсета к более грубым анатомическим и функциональным расстройствам
-
Бандаж (корсет) должен содержаться в чистоте
-
Пациент должен принять горизонтальное положение перед надеванием бандажа (корсета)
-
При надевании не защемлять кожу; не допускать болезненных ощущений
Пуговицы и петли должны располагаться на лицевой стороне бандажа; лямки не должны «впиваться» в мягкие ткани.
-
Пребывание в бандаже (корсете) не должно приводить к нарушениям дыхания и сердечной деятельности
37. Выявление признаков непригодности крови к переливанию, транспортирование крови из отделения переливания крови
-
Непригодная кровь к переливанию, если:
- нарушены сроки и условия хранения крови
- флакон с кровью не имеет герметичности
- верхний слой во флаконе с кровью розовый (гемолиз эритроцитов)
- имеются капли жира, пленки, сгустки
- нечеткая граница между слоями крови во флаконе
-
Хранится кровь в холодильнике при температуре 4 град; транспортировка в специальных контейнерах, нивелирующих изменяющийся температурный режим окружающей среды
38. Составление наборов и определение групповой принадлежности и резус-фактора крови
Определение группы крови с помощью цоликлонов анти-А и анти-В
-
Приготовить тарелку, цоликлоны, стеклянные палочки, часы, исследуемую кровь
-
Разделить тарелку полосой фломастера на 2 части
-
Подписать
-
Нанести на тарелку по одной капле цоликлона анти-А и анти-В
-
Нанести на тарелку по одной капле крови (рядом с каплей цоликлона), каждая из которых в 10 раз меньше капли цоликлона
-
Разными концами стеклянных палочек перемешать
-
Покачивать в течение 2,5 минут
-
Читать результаты реакции:
агглютинации нет – 1 группа крови
агглютинация в анти-А - 2 группа крови
агглютинация в анти-В - 3 группа крови
агглютинация в обеих каплях – 4 группа крови
Определение резус-фактора
-
Приготовить пробирки, пипетки, физраствор (раствор хлорида натрия 0,9 %), универсальный реагент-антирезус, исследуемую кровь
-
Нанести на стенку пробирки каплю универсального реагента-антирезуса и каплю крови, равных по размеру
-
Покачивать 3 минуты
-
Добавить 3 мл. физраствора
-
Перевернуть, не встряхивая
-
Читать результаты реакции:
Наличие агглютинации – исследуемая кровь резус-положительная
Отсутствие агглютинации – исследуемая кровь резус-отрицательная
StudFiles.ru
Читайте также
![Определение резуса Определение резуса]() Определение резуса
Определение резуса- Определение размеров большого родничка алгоритм
- Приготовление оснащения для определения группы крови алгоритм
![Что означает резус фактор крови Что означает резус фактор крови]() Что означает резус фактор крови
Что означает резус фактор крови![Акт определение Акт определение]() Акт определение
Акт определение![Болезнь определение Болезнь определение]() Болезнь определение
Болезнь определение![Определение высоты объекта Определение высоты объекта]() Определение высоты объекта
Определение высоты объекта![Легальное определение юридического лица дано Легальное определение юридического лица дано]() Легальное определение юридического лица дано
Легальное определение юридического лица дано![Деталь определение Деталь определение]() Деталь определение
Деталь определение![Закон джоуля ленца формула и определение Закон джоуля ленца формула и определение]() Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение![Двигатель определение Двигатель определение]() Двигатель определение
Двигатель определение![Машина определение Машина определение]() Машина определение
Машина определение
 Определение резуса
Определение резуса Что означает резус фактор крови
Что означает резус фактор крови Акт определение
Акт определение Болезнь определение
Болезнь определение Определение высоты объекта
Определение высоты объекта Легальное определение юридического лица дано
Легальное определение юридического лица дано Деталь определение
Деталь определение Закон джоуля ленца формула и определение
Закон джоуля ленца формула и определение Двигатель определение
Двигатель определение Машина определение
Машина определение